Le cimici triatomine (generi Rhodnius, Triatoma e Panstrongylus) sono i vettori della malattia di Chagas, o “tripanosomiasi americana”, una parassitosi causata dal protozoo flagellato Trypanosoma cruzi. La malattia prende il nome dal suo scopritore, il medico brasiliano Carlos Chagas (1909).
La tripanosomiasi americana è diffusa soprattutto nelle zone rurali dell’America latina, dove l’infezione è endemica (Fig.1). Tuttavia, in seguito ai flussi migratori, negli ultimi anni è aumentato il numero di casi notificati negli Stati Uniti d’America e in molti paesi europei. Nel 2016, l’Organizzazione Mondiale della Sanità ha stimato che circa 6-8 milioni di persone in tutto il mondo sono infettate da T. cruzi, molte delle quali non sanno di essere malate. Più di 10.000 persone muoiono ogni anno a causa delle complicazioni della malattia di Chagas e circa 25 milioni di persone rischiano di ammalarsi.

La trasmissione avviene principalmente attraverso il contatto con le feci e le urine di cimici infette che di giorno vivono nelle crepe dei muri delle case. Di notte queste cimici ematofaghe diventano attive e mordono solitamente il viso delle persone, da cui il nome di “kissing bugs” (triatomine bacianti). Dopo il pasto di sangue, la cimice (Fig.2) defeca vicino la zona che ha morso e la persona a causa del prurito si gratta, favorendo l’ingresso del parassita nell’organismo. Inoltre, T. cruzi può essere trasmesso attraverso il contatto delle mani imbrattate dalle deiezioni delle cimici con lesioni cutanee, con la bocca o con gli occhi. Il contagio può avvenire anche per via transplacentare, attraverso trasfusioni o trapianti, per via alimentare oppure accidentalmente in laboratorio.

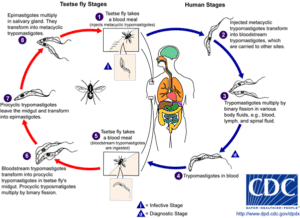
Il ciclo vitale di T. cruzi (Fig.3) comprende quindi una fase replicativa nell’ospite intermedio invertebrato, l’insetto vettore, ed una fase nell’ospite definitivo vertebrato. Nell’ospite vertebrato il parassita si presenta nello stadio di trypomastigote (nel sangue) e amastigote (la forma replicativa intracellulare), mentre nell’intestino dell’insetto diventa epimastigote (forma moltiplicativa) e successivamente trypomastigote metaciclico, che è la forma infettante per l’uomo. Le principali fonti di infezione sono l’uomo, il cane e il gatto nel ciclo domestico; diverse specie di animali selvatici nel ciclo silvestre.
La malattia di Chagas presenta due fasi: la fase acuta e la fase cronica. La fase acuta è spesso asintomatica e dura circa 2 mesi. Nel 50% dei casi si riscontra una lesione cutanea (chagoma) in corrispondenza del sito del morso o edema palpebrale, il cosiddetto segno di Romaña (Fig.4). Possono inoltre essere presenti sintomi aspecifici quali febbre, stanchezza, dolori muscolari e dolori ossei, mal di testa, perdita di appetito, diarrea e vomito.

Durante la fase cronica, l’infezione può rimanere silente per decenni o addirittura per tutta la vita. Tuttavia, alcune persone sviluppano complicanze cardiache (cardiomiopatia), intestinali (megaesofago e megacolon) o neurologiche che possono essere fatali.
La diagnosi può essere effettuata mediante osservazione microscopica di campioni di sangue a fresco o preparati colorati con Giemsa (striscio sottile-Fig.5-o a goccia spessa). Questa tecnica tuttavia può essere utile soltanto nella fase acuta, durante la quale il parassita si trova nel sangue circolante. Durante la fase cronica si ricorre invece a diversi test sierologici (IFA, EIA) o molecolari (PCR). Una tecnica diagnostica molto particolare e sensibile, ma scarsamente applicabile nella pratica, è la xenodiagnosi che consiste nel nutrire in laboratorio cimici non infette con il sangue del paziente e nella successiva analisi delle loro feci per la ricerca di T. cruzi.

La terapia si basa sulla somministrazione di due diversi farmaci antiparassitari efficaci quasi al 100% nella cura della malattia, se somministrati rapidamente dopo l’infezione e l’insorgenza della fase acuta, oltre a farmaci specifici per il trattamento dei sintomi cardiaci e digestivi. Nel 2017, alcuni ricercatori dell’università di Strasburgo, utilizzando la microscopia crio-elettronica, hanno analizzato in dettaglio la struttura di T. cruzi individuando così un nuovo potenziale target terapeutico; scoperta che apre la strada allo sviluppo di nuovi farmaci meno tossici e più specifici.
In assenza di un vaccino e di nuove terapie farmacologiche riveste dunque un ruolo fondamentale la prevenzione, che deve essere condotta su più fronti: il controllo dei vettori e delle trasfusioni, l’utilizzo di zanzariere, la fumigazione delle case con insetticidi, il miglioramento delle condizioni igienico-sanitarie, il trattamento precoce dei malati, lo screening dei figli di madri infette.
Dott.ssa Valentina Amprimo
Sitografia:
- http://www.salute.gov.it/portale/salute/p1_5.jsp?lingua=italiano&id=220&area=Malattie_infettive
- https://www.medicusmundi.it/it/stampa/la-rubrica-del-medico/183-la-tripanosomiasi-americana.html
- http://www.who.int/chagas/disease/en/
- https://www.cdc.gov/
- https://www.sciencedaily.com/releases/2017/10/171026135330.htm
Immagini:
Vorrei essere contattata per fare esame