Immaginate di poter rappresentare idealmente l’organismo umano come un funambolo. Questo è in grado di ergersi, restare dritto e riuscire anche a camminare su una sottile fune.
Tutto il lavoro del funambolo, come quello del nostro corpo, è incentrato sull’equilibrio. Leggende narrano che uno dei tanti segreti adottati da questi acrobati sia quello di fissare un punto, prendere un riferimento e concentrarsi su di esso, in questo modo possono esserci dei piccoli sbilanciamenti, ma tutto poi torna all’EQUILIBRIO.
I fattori in grado di alterare la stabilità ed omeostasi del corpo umano nella sua traversata sulla fune possono essere molteplici e comunemente tendiamo a definirle patologie.
In questi casi, ciò che ci salva, il nostro punto fermo da fissare, è rappresentato dal nostro celeberrimo sistema immunitario. Grazie ad esso, spesso riusciamo a ritrovare il nostro status quo ed a ricominciare ad avanzare.
E se questo non ci fosse? Cosa accadrebbe?
Purtroppo a queste domande, la risposta non è poi così tanto ideale quanto la metafora appena descritta. Vi sono infatti nel mondo una serie di patologie che raffigurano questo quadro, come ad esempio la SCID, l’immunodeficienza combinata grave. Esistono diverse forme di SCID, tutte rappresentate da un’immunodeficienza primitiva con deficit combinato umorale e cellulare che viene determinato da mutazioni su diversi geni.
In parole povere, bambini che nascono con questo difetto, presentano un sistema immunitario inefficiente, caratterizzato da cellule T assenti ed un numero basso o a volte normale (in base alle mutazioni) di cellule B e NK.
Purtroppo entro i 6 mesi di vita, la maggior parte dei neonati con immunodeficienza grave combinata sviluppa infezioni anche gravi, come ad esempio la polmonite da Pneumocystis jirovecii oppure diarrea con conseguente deficit di crescita.
Alcuni presentano la malattia del trapianto contro l’ospite dovuta ai linfociti materni o a emotrasfusioni. Altri possono presentare un deficit di adenosina deaminasi che può causare alterazioni ossee. In aggiunta, in tutte le forme il timo è estremamente piccolo, e il tessuto linfoide può essere ridotto o assente.

Tutte le forme di immunodeficienza grave combinata sono letali nel periodo infantile a meno che non si intervenga sia in ambito diagnostico che terapeutico repentinamente.
La forma più comune di SCID è legata al cromosoma X. Questa forma viene determinata da mutazioni nel gene IL2RG sul cromosoma X e per questo colpisce gli uomini. Il gene in questione codifica per una subunità condivisa dei recettori per l’interleuchina-2 (IL-2), IL-4, IL-7, IL-9, IL-15 e IL-21.
Ad oggi, il trapianto di cellule ematopoietiche allogeniche (allo-HCT) viene considerato lo standard di cura per SCID-X1. Il problema di questo metodo però, risiede nel fatto che esso presenta rischi significativi quali ad esempio la potenziale incompleta ricostituzione immunitaria, la malattia da trapianto contro ospite (GvHD) ed un tasso di sopravvivenza ridotto in assenza di un donatore fratello con antigene leucocitario (HLA).
A causa di tutte queste limitazioni, da anni la ricerca sta cercando di effettuare passi avanti per trovare terapie maggiormente efficienti e meno rischiose.
L’avvento della terapia genica ha determinato un grande salto in avanti per questa tipologia di patologie. Inizialmente si provò a sfruttare questa metodica usando l’integrazione di vettori virali con copie extra del gene funzionale IL2RG in grado di integrarsi casualmente nel genoma di cellule staminali derivate direttamente dal paziente malato. Questa tecnica ottenne fin da subito grandi risultati con diversi pazienti in grado di beneficiarne, ma purtroppo il 25% di essi sviluppò la leucemia da oncogenesi inserzionale.
Questo dato, troppo rilevante per non essere valutato, non ha comunque scoraggiato il mondo della ricerca e molti team hanno continuato ha cercare di trovare la strategia più giusta per contrastare questo grande difetto.
Arriviamo quindi ad oggi, o meglio, ad una ricerca pubblicata su Nature il 9 di aprile da un’equipe statunitense, in cui viene abbandonata l’idea di utilizzare vettori virali per fare spazio ad un grande sistema di editing genetico: CRISPr-Cas9, (di cui si è gia parlato in questo articolo
https://www.microbiologiaitalia.it/2018/05/22/il-sistema-crispr-cas9-componente-dellimmunita-adattativa-dei-batteri/ ).
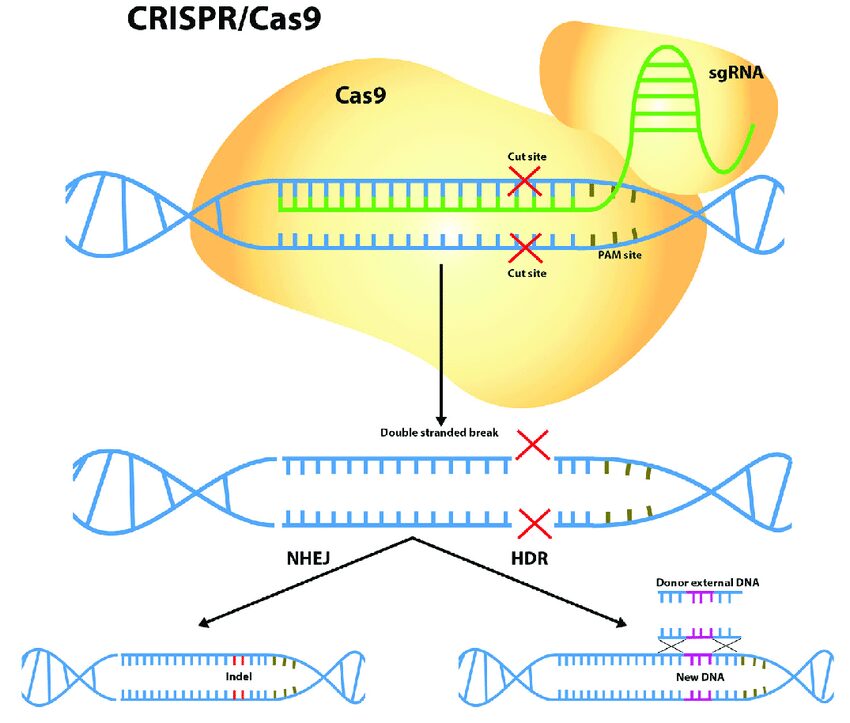
I ricercatori in questione hanno utilizzato questa metodica per creare una rottura a doppio filamento nel DNA. In questo modo si è passati all’ inserimento di una copia sana del gene gamma IL2R nelle cellule staminali di pazienti affetti, deputate alla generazione delle cellule immunitarie.
Nel dettaglio, il team ha ottimizzato le cellule di sei persone con SCID-X1 e poi le ha trapiantate in modelli murini di SCID-X1. Quello che è stato ottenuto è davvero strabiliante. I topi trapiantati, successivamente, non erano in grado solo di fabbricare cellule del sistema immunitario ma mantenevano la loro capacità di creare continuamente nuove cellule, ciò significa che se la terapia fosse davvero efficiente queste cellule modificate potrebbero dare origine al sistema immunitario per tutta la vita del paziente.
Oltre questo, l’altro grande aspetto di questo studio è la SICUREZZA: tutti i topi trapiantati non hanno riscontrato nessuna anomalia successiva al trattamento. Quest’ultimo dato è stato confermato anche da analisi genetiche in cui è stato riscontrato che il sistema CRISPr-Cas9 non ha effettuato tagli off-target in grado di andare ad incidere su geni sani (rischio di questa strategia).
Questa è la prima volta in cui si riscontrano dei risultati così buoni in uno studio effettuato nell’ambito di queste patologie. Ovviamente ora ci vorrà del tempo per traslare la terapia dal laboratorio al clinico, ma se gli studi proseguiranno a gonfie vele, nel giro di pochi anni si potrebbe iniziare a testare nell’uomo e forse, per ricollegarci alla metafora di apertura, aiutare finalmente questi funamboli a ritrovare sempre più il loro equilibrio.
Ilaria Bellini
BIBLIOGRAFIA:
- “Gene correction for SCID-X1 in long-term hematopoietic stem cells.” Pavel-Dinu M. et al. 2019.
- https://www.msdmanuals.com/it-it/professionale/immunologia-malattie-allergiche/disturbi-da-immunodeficienza/immunodeficienza-grave-combinata-severe-combined-immunodeficiency,-scid