Principio
Il test di fermentazione dei carboidrati viene utilizzato per determinare se i batteri possono fermentare o meno un carboidrato specifico. I modelli di fermentazione dei carboidrati sono utili per differenziare tra gruppi o specie batteriche differenti. Tutti i membri della famiglia delle Enterobacteriaceae sono fermentatori di glucosio (possono metabolizzare il glucosio anaerobicamente). La fermentazione del maltosio differenzia Proteus vulgaris (positivo) da Proteus mirabilis (negativo). Sia la Neisseria gonorrhoeae (gonococchi) che la Neisseria meningitides (meningococchi) fermentano il glucosio, ma solo i meningococchi fermentano il maltosio. È possibile eseguire un rapido test di utilizzo dei carboidrati per identificare Corynebacterium diphtheriae ed altre specie di Corynebacterium.
Il test verifica la presenza di acido e/o gas prodotti dalla fermentazione dei carboidrati. A seconda degli organismi coinvolti e del substrato che viene fermentato, i prodotti finali possono variare. I prodotti finali comuni della fermentazione batterica comprendono acido lattico, acido formico, acido acetico, acido butirrico, butanolo, acetone, alcol etilico, anidride carbonica e idrogeno.
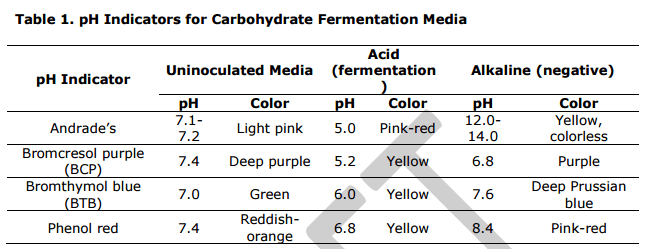
Per questo scopo viene utilizzato un terreno contenente una singola fonte di carboidrati come glucosio, lattosio, saccarosio o altri. Nel mezzo è presente anche un indicatore di pH (come la soluzione di Andrade, violetto di bromocresolo (BCP), Blu di bromotimolo (BTB) o rosso fenolo), che rileverà l’abbassamento del pH del terreno a causa della produzione di acido.
Piccoli tubi invertiti chiamati tubi o campanelle di Durham sono anche immersi capovolti nel mezzo per testare la produzione di gas (idrogeno o anidride carbonica). Se l’organismo produce gas, il gas sposta il fluido presente all’interno del tubo e rimane intrappolato producendo una bolla d’aria visibile.
NB: Il termine fermentazione è spesso usato per descrivere la degradazione o il catabolismo di un carboidrato in condizioni anaerobiche. Pertanto, i batteri capaci di fermentare un carboidrato sono di solito anaerobi facoltativi. In base alle reazioni caratteristiche osservate, i batteri possono essere classificati in 1) organismi fermentativi con la produzione di acido; 2) organismi fermentativi con la produzione di acido e gas; 3) organismi non fermentativi.
Metodo
Composizione e preparazione del terreno
Il Phenol Red Carbohydrate Broth è comunemente usato nel test di fermentazione dei carboidrati. La fonte di carboidrati può variare in base ai requisiti del test. Il carboidrato può comprendere, come detto precedentemente: glucosio, lattosio, maltosio, mannitolo o sucrosio. Il terreno è composto da:
- Trypticase o peptone 10 g;
- Cloruro di sodio (NaCl) 5 g;
- Estratto di manzo (facoltativo) 1 g;
- Rosso fenolo (7,2 ml di soluzione di rosso fenolo allo 0,25%) 0,018 g;
- Fonte di carboidrati: 10 g.
Per la preparazione del terreno bisogna procedere come segue:
- Preparare il brodo mescolando tutti gli ingredienti in 1000 ml di acqua distillata/deionizzata e riscaldare delicatamente per dissolverlo (utilizzare una singola fonte di carboidrati in base alle proprie esigenze);
- Riempire le provette da 13 x 100 mm con 4-5 ml di brodo;
- Inserire una campanella di Durham per rilevare la produzione di gas;
- Sterilizzare in autoclave i supporti del test preparati a 121 °C per 15 minuti (quando si utilizzano arabinosio, lattosio, maltosio, salicina, saccarosio, trealosio o xilosio, sterilizzare in autoclave a 121 °C per soli 3 minuti poiché questi carboidrati sono soggetti a degradazione in autoclave).
Il brodo preparato sarà di colore rosso chiaro e il pH finale dovrebbe essere 7,4 ± 0,2.
Inoculo ed incubazione
- Inoculare asetticamente ciascuna provetta con il microrganismo del test utilizzando un’ansa sterile;
- Incubare le provette a 35-37 °C per 18-24 ore. Periodi di incubazione più lunghi possono essere necessari per confermare un risultato negativo.
Risultati attesi
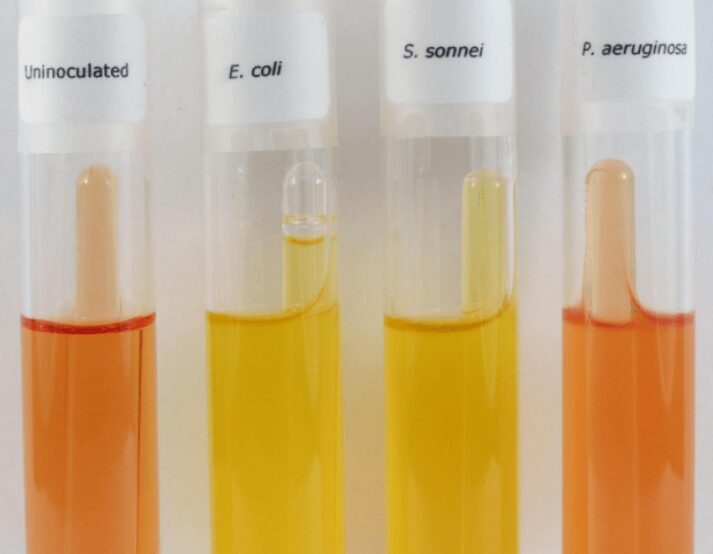
- Acido
- produzione: dopo l’incubazione, il liquido nel tubo diventa giallo (indicato dal cambiamento nel colore dell’indicatore rosso fenolo). Il viraggio indica che c’è produzione di acido dalla fermentazione del carboidrato (zucchero);
- non produzione: la provetta contenente il terreno rimarrà rossa, indicando che i batteri non possono fermentare quella particolare fonte di carboidrati presente nel terreno.
- Gas
- produzione: una bolla (piccola o grande che dipenderà dalla quantità di gas prodotta) sarà visibile nella campanella di Durham;
- non produzione: non ci saranno bolle nella campanella di Durham, ciò significa che i batteri non producono gas dalla fermentazione di quel particolare carboidrato presente nel terreno.
Limitazioni del test
- Si raccomanda di eseguire test biochimici, immunologici, molecolari o di spettrometria di massa su colonie provenienti da colture pure per una completa identificazione microbica;
- Potrebbe essere necessario invertire la provetta prima dell’inoculo se le bolle sono intrappolate nella campanella di Durham. Le bolle intrappolate che non vengono rilasciate possono portare a risultati falsi positivi.