Premessa
La modulazione del microbiota intestinale mediante l’utilizzo di prebiotici rappresenta la motivazione strategica per il loro impiego in formulazioni alimentari potenzialmente utili per migliorare la salute umana. Al momento, la ricerca scientifica deve ancora risolvere diversi quesiti. Il latte umano è una fonte ricchissima di prebiotici, pertanto risulta interessante comprenderne meglio l´azione prebiotica del latte materno.

I prebiotici nel latte materno possono aiutare il naturale sviluppo del neonato; modulano infatti la crescita e la funzione dei batteri benefici presenti nell’intestino del neonato.
Definizione di prebiotico
Il termine “prebiotico” fu coniato negli anni ‘90 in riferimento a composti non digeribili in grado di promuovere la crescita di specifici componenti del microbiota intestinale umano (ad esempio Bifidobacterium).
Più recentemente, l’ultima revisione delle “Linee guida su probiotici e prebiotici” del Ministero della Salute, definisce i prebiotici come “un costituente degli alimenti non vitale che conferisce un beneficio alla salute mediante una modulazione del microbiota”.
I prebiotici si caratterizzano per indigeribilità nel tratto gastrointestinale e resistenza alle condizioni chimiche e fisiche dello stesso, non assimilabilità nell’intestino tenue, fermentescibilità da parte del microbiota intestinale e capacità di stimolare la proliferazione di specifici microrganismi intestinali la cui attività è associabile ad effetti positivi per la salute umana.
Quest’ultima caratteristica rappresenta l’effetto peculiare dei prebiotici che ha dato particolare impulso agli studi su questi composti, la cui vicenda storica e scientifica è intimamente legata agli studi sul microbiota intestinale umano.
Ricerche sul latte
Già nel 1888 Eschbach identificava nel latte umano e nel latte vaccino una frazione glucidica più complessa del lattosio, comunque diversa tra i due latti.
Solo 40 anni dopo, questa frazione fu in parte caratterizzata chimicamente e denominata “gynolactose” dai suoi scopritori Polonowski e Lespagnol. Per la prima volta, i ricercatori postularono la presenza di acido N-acetilneuraminico.
Parallelamente, agli inizi del secolo scorso, le ricerche di Tissier sul microbiota fecale di bambini allattati al seno o meno posero le basi per lo studio dell’azione prebiotica del latte materno umano sullo sviluppo della microflora intestinale del lattante che negli stessi anni era stata caratterizzata nelle feci dei bambini allattati al seno come appartenente prevalentemente ai bifidobatteri.
Già attorno al 1900, questa evidenza era stata associata all’esistenza del cosiddetto “fattore bifido” nel latte umano, ossia alla presenza di un componente termoresistente e non appartenente alla frazione proteica del latte in grado di stimolare la crescita dei bifidobatteri nell’intestino del lattante. Questo fattore fu inizialmente identificato come una vitamina; negli anni ’30 avvenne poi la scoperta delle vitamine B da parte di György.
Circa 20 anni dopo, proprio György (insieme a Kuhn) dimostrò invece che i fattori di crescita per la microflora bifida presenti nel latte umano erano ascrivibili a una frazione oligosaccaridica contenente anche N-acetilglucosammina (GlcNAc).
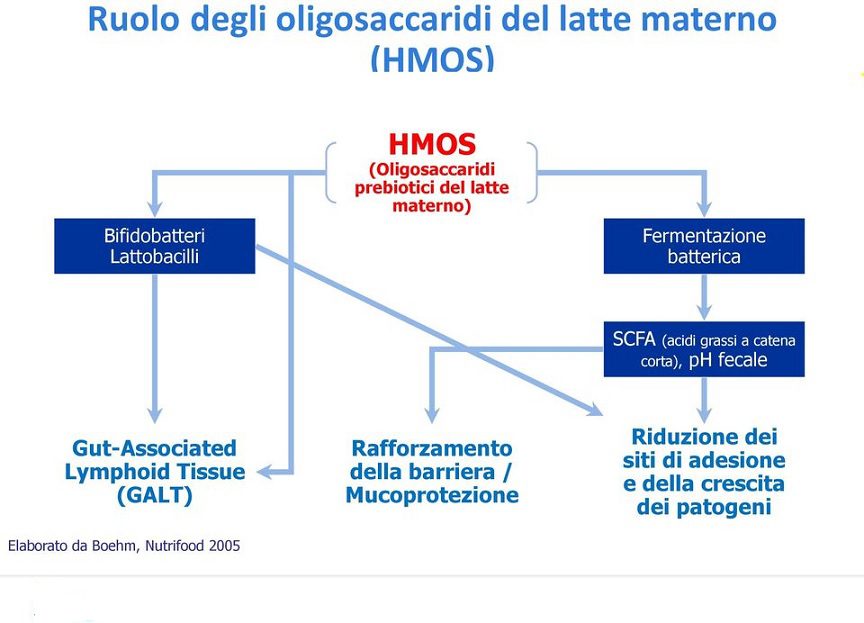
Negli anni ’70 e ‘80, ulteriori evidenze scientifiche evidenziarono il ruolo della frazione oligosaccaridica nel modificare il microbiota intestinale. Permisero quindi di comprendere l’azione prebiotica del latte materno umano e l’interazione della componente microbica con il tessuto linfoide intestinale che, come noto, comprende buona parte delle cellule immunocompetenti dell’organismo umano.
Inoltre, la fermentazione operata dal microbiota sugli oligosaccaridi introdotti con gli alimenti porta alla formazione di acidi grassi a corta catena (SCFA) quali il butirrato, l´acetato ed il propionato, composti fondamentali per la fisiologia del grosso intestino.
Gli SCFA intervengono nel metabolismo energetico di colonociti ed enterociti con effetto trofico positivo sull’epitelio intestinale.
La potenziale azione prebiotica del latte materno umano rappresenta un settore di studio interessante al fine di un utilizzo in ambito alimentare e salutistico.
Più di cento varietà di zuccheri
I grassi essenziali, le proteine, i fattori di crescita presenti nel latte materno sono alla base delle raccomandazioni dell’OMS.
Altrettanto interessanti, sebbene finora poco conosciuti, sono gli oligosaccaridi, zuccheri complessi a catena semplice o ramificata composta da cinque moduli diversi che non rappresentano una fonte di energia per i piccoli consumatori.
Le ghiandole mammarie non ne producono solo alcune varianti, ma diverse centinaia.
Ogni donna ha il suo repertorio personale, composto da elementi come lattosio (glucosio + galattosio), fucosio, N-acetilglucosamina e N-acetilneuraminico con una lunghezza che varia dalle 2 alle 32 unità.
Rispetto agli animali domestici quali la pecora o la mucca il secreto mammario femminile contiene una quantità di questi particolari zuccheri da cento a mille volte superiore.
Anche se l’effetto della portata non è ancora stato completamente chiarito i ricercatori conoscono almeno alcune delle loro funzioni.
Nell’intestino impediscono ai germi patogeni di proliferare, rafforzano il sistema immunitario e probabilmente sono coinvolti anche nello sviluppo del cervello. Probabilmente non sono d’aiuto solo al bambino, ma anche alla madre.
Gli oligosaccaridi del latte materno umano
Se si considerano gli importanti effetti esercitati dagli oligosaccaridi naturalmente presenti nel latte umano, non stupisce che le ricerche per individuare i potenziali composti prebiotici siano partite dallo studio delle caratteristiche chimiche e strutturali degli oligosaccaridi del latte umano.
Questi oligosaccaridi devono essere infatti considerati come il modello di prebiotico, almeno per il loro effetto stimolante la crescita di bifidobatteri nel colon dei bambini allattati al seno.
In particolare, nel latte materno sono stati individuati numerosi oligosaccaridi che si differenziano per grado di polimerizzazione, contenuto glucidico, tipo di legami glicosidici e ramificazioni presenti.
Gli stessi oligosaccaridi sono invece accomunati dalla presenza di lattosio, galattosio, fucosio, GlcNAc, N-acetilgalattosammina (GalNAc) e dell’acido sialico N-acetilneuramminico (NeuAc). Sebbene la complessità di questi oligosaccaridi non permetta la loro esatta quantificazione, è comunque possibile affermare che il latte materno maturo contiene 5-13 g/L di oligosaccaridi liberi ossia un livello nettamente superiore a quello (0,03-0,07 g/L) del latte vaccino.
Nel latte di capra e pecora il contenuto risulta mediamente pari a 0,25-0,39 g/L e 0,02-0,04 g/L. Contenuti superiori (20-25 g/L) caratterizzano invece il colostro umano contro valori di circa 1 g/L in quello bovino.
Analizziamo più in dettaglio gli oligosaccaridi del latte umano evidenziando alcune delle caratteristiche prebiotiche.
Gli HMO (HMO – Human Milk Oligosaccharides)
Gli HMO (oligosaccaridi del latte umano) comprendono un’ampia famiglia di oligosaccaridi estremamente eterogenei e presenti in elevate concentrazioni nel latte materno.
Nel latte umano sono stati identificati circa 200 HMO.
Essi sono generalmente noti per i loro effetti benefici nella formazione del microbiota nei neonati, sebbene producano il medesimo beneficio anche negli adulti.
Rappresentano il terzo componente solido del latte materno in termini di abbondanza, dopo lattosio (70 g/l) e grassi (30-60 g/l), con concentrazioni tipiche di 10-15 g/l nel latte maturo a termine, e superano il contenuto proteico del latte materno che di solito è 6,0-8,0 g/l.
Gli HMO sono in grado di impedire l’attacco di agenti patogeni e tossine alle cellule epiteliali del tratto gastrointestinale, come Campylobacter jejuni, Escherichia coli, Vibrio cholerae, Salmonella typhi, Helicobacter pylori, tossine batteriche, Entamoeba histolytica e virus; questo processo riduce la patogenicità di tali agenti dal momento che il legame ai recettori sulle cellule epiteliali è un prerequisito per l’infezione (Fig. 3).
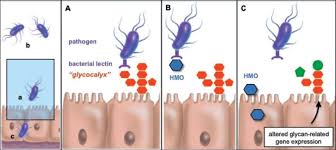
Quando agenti patogeni o tossine si legano agli HMO, vengono rimossi dal tratto gastrointestinale e non causano dunque alcuna patologia.
Quindi, gli HMO sono agenti protettivi contro le infezioni enteriche negli adulti, così come nei bambini.
L’integrazione alimentare mediante l’uso di HMO rappresenta quindi una strategia per promuovere un sano microbiota intestinale e produrre benefici salutari ad adulti e neonati.
Gli HMO del latte materno si compongono di diversi monosaccaridi, in particolare glucosio, galattosio, fucosio, N-acetilglucosamina e acidi sialici (acido N-acetilneuraminico).
Lo zucchero fucosio è anche una molecola insolita poiché ha una configurazione L, mentre le altre molecole di zuccheri dell’organismo hanno una configurazione D.
La struttura degli HMO ha un nucleo di lattosio con l’estremità riducente allungata con unità fucosilate e/o unità di sialil N-acetil-lattosamina.
Gli HMO fucosilati sono risultati la componente più cospicua (~77%), mentre gli HMO sialilati rappresentano circa il 16% degli HMO totali. Gli HMO fucosilati sono molecole neutre, mentre gli HMO sialilati sono molecole acide. Nel latte umano, gli HMO più abbondanti sono il 2’-fucosillattosio, con una concentrazione di circa 2 g/l (Fig.1)
Gli HMO sono resistenti all’idrolisi degli enzimi intestinali e raggiungono il colon, dove agiscono come prebiotici.
In tale distretto anatomico possono promuovere la crescita di bifidobatteri, le specie predominanti nel microbiota dei neonati allattati al seno, con conseguente produzione di metaboliti microbici caratteristici della fermentazione dei carboidrati.
Circa l’1% degli HMO ingeriti viene assorbito nella circolazione sistemica del bambino e viene escreto nelle urine, dove può anche contribuire all’attività anti-patogena, mentre la maggior parte viene metabolizzata dal microbiota intestinale o escreta intatta nelle feci dei neonati.
Inoltre, gli HMO assomigliano alla struttura di alcuni glicani della superficie delle cellule epiteliali dell’ospite e possono quindi fungere da “recettori esca” in grado di impedire l’adesione del patogeno alle superfici epiteliali e la successiva traslocazione.
Sappiamo, inoltre, che gli HMO migliorano la difesa dell’ospite modulando l’immunità e promuovendo la funzione di barriera intestinale.
L’HMO più abbondante nel latte materno, è il 2′-fucosil-lattosio che favorisce selettivamente la crescita dei bifidobatteri, principalmente Bifidobacterium longum ssp. infantis e Bifidobacterium bifidum, ma stimola anche la crescita di alcune specie di Bacteroides.
La concentrazione di 2′-fucosil-lattosio è massima all’inizio della lattazione durante il primo mese dopo il parto e di recente, questo HMO è stato sintetizzato ed è ora disponibile in alcune formule commerciali per neonati.
Le esperienze cliniche di alimentazione di latte in polvere per bambini integrato con HMO hanno dimostrato che l’aggiunta è sicura, ben tollerata, assorbita ed escreta con un’efficienza simile a quello presente nel latte materno.
Inoltre, i bambini nutriti con formula supplementata presentavano benefici immunitari, un minor numero di infezioni respiratorie riportate dai genitori e un miglioramento dei sintomi di intolleranza alla formula, dimostrando di essere più vicina dal punto di vista compositivo e funzionale al latte materno.
Da qui, una volta sintetizzato l’HMO più abbondante, l’interesse di valutare gli effetti della supplementazione sulla composizione del microbiota intestinale dell’adulto e sui sintomi gastrointestinali.
In totale, 100 volontari adulti sani di età compresa tra 19 e 57 anni sono stati arruolati in uno studio che mirava a fornire la prima valutazione sulla sicurezza, tolleranza e influenza sulle popolazioni del microbiota intestinale dell’adulto.
Lo studio ha dimostrato che l’assorbimento di 2′-fucosillattosio, e di un secondo HMO, il latto-N-lattosio, per un periodo di 2 settimane è sufficiente per modulare il microbiota: sono stati osservati aumento dell’abbondanza relativa di bifidobatteri, fino a > 25% in alcuni individui, e una riduzione dell’abbondanza relativa di due phyla, Firmicutes e Proteobacteria.
Questa modulazione si è verificata rapidamente, entro 1-2 settimane, e l’effetto bifidogenico è stato significativo nonostante una normale dieta adulta non standardizzata.
L’aumento osservato di bifidobatteri era dose-dipendente ma non correlato all’abbondanza iniziale di bifidobatteri.
Cibo per i bifidobatteri e trappola per i germi patogeni
I bifidobatteri svolgono un ruolo importante nella colonizzazione iniziale del piccolo intestino vergine.
Attraverso la loro crescita riducono lo spazio ed il cibo a disposizione per altri batteri sgradevoli. Mentre il metabolismo umano non può fare molto con i polisaccaridi, alcuni bifidobatteri hanno sviluppato un’intera batteria di glicosidasi con cui scindere le catene di zuccheri e riuscire addirittura ad utilizzarli come unica fonte di carboidrati.
Le catene di zuccheri fungono non solo da materiale di combustione, ma anche come ancoraggio all’epitelio intestinale, da cui sporgono.
Alcuni ceppi di Escherichia coli, o anche gli Helicobacter vi si ancorano volentieri.
I glicani insieme a residui del fucosio inibiscono l’attacco del patogeno Campylobacter jejuni responsabile di forme diarroiche.
Come avviene anche con altri batteri, gli zuccheri del latte li ingannano fornendo prima loro l’ancora necessaria, migrando però in seguito verso l’ano. Anche le tossine batteriche basate su lectina si legano ai glicani, e possono causare danni considerevoli.
Gli HMO sono in grado di intercettarli.
I bambini allattati al seno soffrono in misura leggermente inferiore d’infezioni respiratorie o all’orecchio.
Questo potrebbe essere legato a qualche azione specifica delle catene di zuccheri contro lo Streptococcus pneumoniae, la Pseudomonas aeruginosa e l’Haemophilus influenzae, poichè nei neonati il latte raggiunge anche queste regioni.
Contro amebiasi, norovirus e HIV
Dai carboidrati del latte non dipende soltanto la vita di alcuni batteri.
Specialmente nei paesi in via di sviluppo, il parassita Entamoeba histolytica causa spesso malattie del tratto intestinale mortali per i neonati.
Anche in questo caso gli zuccheri impediscono il legame tra lectina e l’epitelio intestinale.
Il latte materno complica la vita anche ai virus, in particolar modo alcuni virus che provocano diarrea come il norovirus e il rotavirus. Dall’Africa arriva la notizia che quattro bambini su cinque non si contagiano né nel grembo materno e neanche in seguito a causa del latte di madri HIV positive.
A ciò contribuiscono alcuni degli zuccheri nel latte aventi un recettore di cellule dendritiche a cui altrimenti la glicoproteina 120 del HIV si ancorerebbe.
Alimentazione nel cervello
Nel cervello la crescita delle cellule nervose dipende della fornitura di acido neuraminico, componente importante per i gangliosidi e le glicoproteine.
Gli HMO contengono questa sostanza in alte concentrazioni. Da ciò potrebbe dipendere che, all’inizio della scuola, i bambino allattati al seno hanno un quoziente intellettivo leggermente superiore
Conclusioni
Sebbene sia stato per lungo tempo considerato sterile, il latte materno contiene quindi un ricco microbiota formato da oltre 700 specie, dominato da stafilococchi, streptococchi, bifidobatteri e batteri lattici.
Dunque, nei bambini allattati al seno rappresenta una fonte importante per la colonizzazione dell’intestino; è stato suggerito che questa modalità di colonizzazione giochi un ruolo cruciale per la salute. Questo in quanto, tra le altre funzioni, potrebbe proteggere il neonato dalle infezioni e contribuire alla maturazione del sistema immunitario.
Il latte materno influenza il microbiota intestinale anche indirettamente, grazie alla presenza di oligosaccaridi con attività prebiotica detti anche HMO che stimolano la crescita di gruppi batterici specifici quali stafilococchi e bifidobatteri.
In effetti, i primi oligosaccaridi che ingeriamo sono quelli presenti nel latte materno.
Considerato il ruolo degli HMO, interventi sicuri e ben tollerati, come la loro integrazione, rappresentano nuovi approcci che vale la pena considerare per ricostituire i bifidobatteri negli individui che presentano bassi livelli di questi batteri e può rappresentare uno strumento prezioso per ripristinare l’omeostasi anche in adulti che presentino condizioni di disbiosi intestinale.
Anche se non abbiamo ancora molti studi clinici sull’adulto per cui è difficile valutare la reale potenzialità degli HMO nell’ambito delle patologie gastroenteriche, in particolare nelle IBD, possiamo ipotizzare che in futuro saranno ampiamente utilizzati in associazione con i probiotici per potenziarne l’azione di riequilibrio del microbiota.
Giuseppe Chindemi
Fonti
- The effect of 2′-fucosyllactose on simulated infant gut microbiome and metabolites; a pilot study in comparison to GOS and lactose. Sci Rep. 2019 Sep 13;9(1):13232.
- Review of the clinical experiences of feeding infants formula containing the human milk oligosaccharide 2′-fucosyllactose. Nutrients. 2018 Sep 21;10(10).
- Oral supplementation of healthy adults with 2′-O-fucosyllactose and lacto-N-neotetraose is well tolerated and shifts the intestinal microbiota. Br J Nutr. 2016 Oct;116(8):1356-1368.
- 2′-fucosyllactose: an abundant, genetically determined soluble glycan present in human milk. Nutr Rev. 2013 Dec;71(12):773-89.