Batteri speciali: i Bifidobatteri
I Bifidobacterium sono batteri gram+ anaerobi (più propriamente, microaerofili poiché prediligono habitat in cui la concentrazione di ossigeno è più bassa di quella normalmente presente a livello atmosferico) e fermentatori. In particolare, tale genere appartine al phylum degli Actinobacteria.
Specificamente, il genoma di questi batteri detiene un contenuto di GC superiore al 54%. Parliamo di microorganismi pleomorfi in quanto si presentano in varie forme: dal classico bacillo regolare a forme variamente ramificate.
In particolare, ad oggi se ne distinguono circa 28 specie diverse, tutte caratterizzate dalle seguenti peculiarità:
- Immobili;
- non sporigene;
- catalisi negative.
Importanza della composizione del microbiota intestinale
I Bifidobatteri interagiscono normalmente con l’organismo umano e fanno parte del cosiddetto microbiota intestinale. In particolare, una forte interazione dell’organismo umano con questi batteri si verifica durante l’allattamento.

Difatti, si è visto che c’è una fortissima correlazione tra presenza di bifidobatteri e tipo di allattamento ricevuto dal neonato (se di tipo materno, artificiale o formulato).
In particolare, laddove il latte è di tipo materno, la flora microbica intestinale totale del neonato avrà, a venti giorni, un quantitativo di bifidobatteri che raggiunge addirittura il 70% del totale, dove il restante 30% si suddividerà tra le varie altre specie presenti, come Escherichia coli ed i Bacteroides.
Invece, nel caso di allattamento con latte artificiale i bifidobatteri diminuiranno nettamente ed a venti giorni, si giungerà ad una quantità corrispondente al 35%.
La composizione del microbiota intestinale è importantissima; infatti, si ritiene che essa possa ripercuotersi sul corretto innesco della risposta immunitaria di un individuo e sul giusto dialogo con alcune molecole fondamentali nello sviluppo del sistema nervoso.
Pertanto, esistono in commercio numerose preparazioni a base di bifidobatteri, come l’infantis, il longum ed il brevis.

La loro composizione varia a seconda delle fasi di crescita dell’individuo ed è pensata per arricchire il latte somministrato al neonato anche di questa particolare specie microbica, riportando ad un certo livello di corrispondenza il microbiota degli individui alimentati artificialmente rispetto a quello di chi viene nutrito con latte materno.
Uso di bifidobatteri per la terapia genica di tumori solidi
Un recente studio ha evidenziato un possibile impiego di B. longum geneticamente ingegnerizzati ed utilizzati come trasportatori di farmaci sistemici nell’approccio terapeutico di pazienti con tumore al seno.
Terapia convenzionale con 5-fluorouracile
Classicamente, in chemioterapia come approccio al tumore al seno si utilizza il 5-fluorouracile (5-FU), un analogo di base dell’uracile.
Innanzitutto, occorre somministrarne una dose molto elevata e ciò comporta effetti collaterali a livello delle cellule normali.
Specificamente, il 5-FU, in quanto inibitore competitivo della timidilato sintetasi (enzima preposto alla sintesi di timina), agisce andando a danneggiare il DNA. Inoltre, si avrà danno all’RNA per interferenza del suddetto farmaco sull’RNA polimerasi, con successiva inibizione della sintesi proteica.

Inoltre, a causa della carenza di timine disponibili, il 5-FU verrà incorporato nel DNA inducendo alterazioni della sua stabilità.
Pertanto, in seguito a tutti questi avvenimenti, la cellula tumorale verrà fortemente compromessa e andrà rapidamente incontro a morte cellulare.
Tuttavia, in assenza di selettività cellulare, tale farmaco andrà a colpire anche le cellule del tessuto sano, sviluppando una notevole tossicità.
Tra gli effetti collaterali, figurano: leucopenia, piastrinopenia ed anemia; questo perché, in assenza di selettività cellulare, le cellule maggiormente colpite saranno quelle a duplicazione più rapida.
Per lo stesso motivo, altri effetti collaterali si verificano a livello di capelli, derma e congiuntiva; per cui si avranno: alopecia, dermatiti, iperpigmentazioni cutanee e congiuntiviti.
Quindi, è necessario avere un approccio quanto più selettivo possibile, individuando quante più differenze esistenti tra un tessuto sano ed uno malato.
Regioni necrotiche ed ipossiche
Una caratteristica di molti tumori solidi umani e murini è la presenza di regioni necrotiche ed ipossiche. Difatti, a livello dei tessuti oncologici la pressione parziale di O2 (fisiologicamente compresa tra 25 e 66 mmHg) cala drasticamente arrivando a valori compresi tra 10 e 25 mmHg.
Ciò è determinato dal fatto che in corrispondenza del tessuto tumorale l’O2 viene utilizzato molto più rapidamente.
Dunque, tale ipossia fornisce alle cellule tumorali un vero e proprio microambiente che facilita la radio-resistenza e la chemio-resistenza, costituendo un forte limite per le terapie convenzionali.
Terapia genica di vettorizzazione di attività enzimatiche in cellule tumorali
A tal proposito, si è cercato di sfruttare quest’aspetto facendo in modo di vettorizzare, ossia di far giungere solo alle cellule tumorali, delle particolari attività enzimatiche capaci di generare, solo a tale livello, la tossicità di un farmaco utilizzato.
In particolare, alcune specie di batteri, soprattutto dei generi Clostridium e Bifidobacterium, possono colonizzare selettivamente le regioni ipossiche dei tumori solidi dopo somministrazione sistemica.
Pertanto, si è pensato di associare il B. longum geneticamente modificato con la citosina deaminasi e la 5-fluorocitosina (5-FC).
Specificamente, il 5-fluorouracile (5-FU) è un farmaco molto tossico anche per le cellule sane. Nella fattispecie, tale composto deriva da un pro-farmaco precursore, la 5-fluorocitosina (5-FC).
Essa ha una tossicità molto più bassa che si esplica solo quando la citosina deaminasi la converte in 5-fluorouracile (5-FU). Quindi, somministrando la 5-FC per via sistemica, avremo che questa raggiungerà sia le cellule tumorali che quelle sane senza avere su di esse particolari effetti dannosi.
Però, se insieme alla somministrazione di 5-FC si riuscisse a concentrare l’azione della citosina deaminasi solo a livello del tessuto tumorale, si avrebbe la conversione in 5-FU e la sua conseguente azione tossica solo a livello del focolaio tumorale. Ed è proprio a tal proposito che entra in gioco l’utilizzo dei Bifidobatteri.
Infatti, essendo tali batteri in grado di andare ad occupare regioni ipossiche, come appunto i tumori solidi, si è ipotizzato che dopo essere stati somministrati per via sistemica, possono andare ad agire specificamente a livello di quest’ultimo.
Crescita selettiva di B. longum nei tessuti tumorali
Per verificare tale ipotesi, sperimentalmente sono stati effettuati studi su due modelli animali: il topo ed il ratto che è più grande come taglia e per cui la carica batterica utilizzata per colonizzare un tumore sarà ovviamente di entità maggiore.
Innanzitutto, si è indotto il tumore. Nella fattispecie:
- nei topi attraverso l’inoculazione di vere e proprie cellule tumorali nel muscolo della coscia;
- mentre, nei ratti mediante la somministrazione per via orale di una sostanza tumorigena.
Successivamente, alle cavie viene somministrato B. longum in vena caudale, dopodiché esse vengono sacrificate per andare a valutare la localizzazione del suddetto batterio nei tessuti normali e tumorali prelevati.
In particolare, prima di essere sottoposti alla conta del numero di colonie batteriche, gli omogenati tissutali sono posti in coltura in condizioni anaerobie per tre giorni.
Risultati
Quindi, al giorno 0, nei polmoni ed in maniera simile in tutti gli altri tessuti sani si ha più o meno la stessa quantità di CFU; però, già dopo 24 ore questa quantità precipita e, dopo 96-168 ore, non si trovano più cellule batteriche di B. longum.
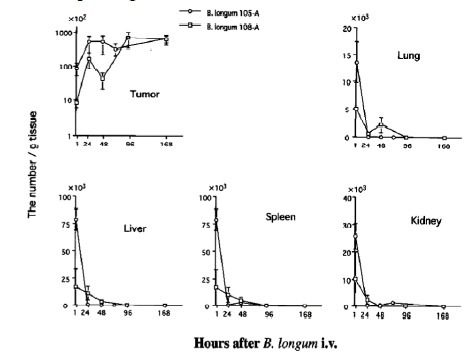
Ciò è dovuto al fatto che, a livello polmonare così come negli altri tessuti sani, la concentrazione di O2 è sufficientemente elevata da non garantire la sopravvivenza delle cellule batteriche.
Invece, a livello tumorale, la carica batterica somministrata al giorno 0 incrementa e, dopo 48 ore, è maggiore addirittura di quasi dieci volte, restando poi stabile nel tempo.
Questa situazione appare ancora più evidente piastrando gli omogenati di tessuto sano e tessuto tumorale.

Trasformazione di B. longum con il plasmide pBLES100-S-eCD
A questo punto, per rendere B. longum oltre che selettivo anche efficacie nel contrastare le cellule tumorali, si è provveduto alla sua modifica genetica.
In particolare, poiché il gene che codifica per la citosina deaminasi non è presente nel genoma dei Bifidobatteri, si è preso in considerazione un microorganismo che lo possiede: Escherichia coli.
Quindi, a partire da E. coli si è prelevato questo gene e lo si è inserito in un plasmide compatibile con B. longum, per l’appunto il plasmide pBLES100-S-eCD.
Successivamente, questo plasmide è stato trasformato in B. longum mediante elettroporazione, consentendo, dunque, al batterio di produrre la citosina deaminasi.
Pertanto, somministrando B. longum ai topi che avevano sviluppato il tumore, avremo che tale batterio andrà a localizzarsi solo a livello del tessuto tumorale.
Così facendo, in seguito a somministrazione di 5-FC, il profarmaco andrà in circolo in tutti i tessuti, ma solo a livello tumorale, dov’è presente B. longum che produce la citosina deaminasi, si avrà la produzione del 5-FU, il farmaco efficace nel contrastare le cellule tumorali.
Tale studio, ora in fase tre di trial clinici, prevede come step successivi quelli di andare a verificare questo approccio su pazienti veri e propri.
L’unico limite della terapia potrebbe essere l’efficacia solo su tumori solidi primari.
Giovanna Spinosa
Fonti
- https://www.microbiologiaitalia.it/batteriologia/bifidobacterium/;
- https://www.nature.com/articles/7700122;
- https://link.springer.com/article/10.1023/A:1010644217648.
Crediti delle immagini
- Figura 1: https://microbioma.it/gastroenterologia/bifidobacterium-longum-potenziale-probiotico-anti-obesita/;
- Figura 2: https://www.uppa.it/nascere/allattamento/allattare-un-bambino-adottivo-la-testimonianza-di-una-madre/;
- Immagine 3: https://www.supersmart.com/it/shop/digestione/bifidobacterium-longum-integratore-0507;
- Immagine 4: https://slideplayer.it/amp/531002/.