L’impatto sanitario dei metodi di disinfezione dei cibi è un punto cruciale negli ultimi studi scientifici applicati alla microbiologia alimentare. Uno dei più temuti patogeni residenti su matrici alimentari, il batterio Listeria monocytogenes, mostra qui il fianco a future riduzioni della propria celeberrima resistenza. Solo così, infatti, si potrebbe pensare di abbattere la carica batterica, senza dover ingerire residui tossici di ossidanti chimici.
“Ego te baptìzo Listeriam”
Nel XIX secolo, un medico chirurgo e microbiologo inglese compì numerosi studi sull’eziologia microbica di infezioni chirurgiche: era Lord Baron Joseph Lister (Fig.1) e divenne, poi, il fondatore della chirurgia moderna.

Nel 1924, E.G.D. Murray ed i suoi collaboratori scoprirono, presso l’Università di Cambridge, una patologia in grado di determinare morte immediata nei conigli. Essa era caratterizzata da un concomitante aumento dei monociti, globuli bianchi deputati al contrasto delle infezioni. Il batterio isolato fu quindi nominato Bacterium monocytogenes: letteralmente “batterio capace di generare (-genes) un gran numero di monociti (monocyto-)”. Tale prima denominazione venne sancita con la pubblicazione di Murray del 1926.
Nel 1940, infine, fu il medico scozzese Harvey Pirie che decise di sostituire il nome del genere con quello dell’illustre antesignano: nacque Listeria monocytogenes.
L’infinita lotta tra industria alimentare e Listeria monocytogenes
Listeria monocytogenes è un batterio intracellulare facoltativo. Questo Gram-positivo è un Firmicutes che causa infezioni alimentari molto gravi, note come listeriosi. La listeriosi fa registrare un tasso di mortalità del 24%-30% e preoccupa soprattutto donne in gravidanza e soggetti immunocompromessi. Gli esiti più drammatici sono quelli che si accompagnano a sintomi di aborto, morte neonatale, gastroenterite febbrile, setticemia, meningite ad elevata mortalità. La sintomatologia associata all’infezione da Listeria è sovrapponibile in tutti gli ospiti sensibili. Essendo ubiquitario in natura, il batterio è una minaccia che incombe su ogni prodotto vegetale fresco (frutta, verdura) e corre poi per le carni e gli escreti dei suoi diretti consumatori: gli animali d’allevamento. Listeria monocytogenes è stata, infatti, isolata sia in carni bovine e pollame che nel pescato allevato.
Il batterio si trova, dunque, ovunque in natura: nell’acqua, nel suolo, sulle piante. Ingerito dagli animali, si riversa nel loro latte e nelle loro carni. All’uomo giunge, perciò, tramite consumo di questi prodotti contaminati: carni, salumi, formaggi a pasta molle ed a base di latte crudo, pesce.
L’origine ambientale lo colloca spesso sulla vegetazione di cui si nutrono i capi d’allevamento sia in pascolo sia mediante alimenti insilati: le erbe spontanee sfalciate e conservate in stock freschi (senza essiccazione preventiva) infettano gli animali che poi liberano nuovamente il batterio nell’ambiente con le feci. Diverso è invece il caso di una alimentazione con fieno o mangimi compositi, a seguito della cui assunzione non si registra nelle feci alcuna presenza del patogeno.
Fonti e contaminazioni secondarie
In realtà, Listeria monocytogenes può contaminare cibi umani anche in fasi successive di processamento industriale delle matrici alimentari. Molti ceppi batterici del genere Listeria diventano residenti stabili degli strumenti industriali: il microrganismo, infatti, colonizza facilmente diversi materiali presenti nelle aree di preparazione degli alimenti.
La preoccupazione dell’industria alimentare è, inoltre, giustificata dalla capacità del batterio di sopravvivere e crescere in diverse condizioni ambientali: ad ampi intervalli di pH, elevata concentrazione di sale e con temperature comprese tra -2 e -42 °C. Il periodo di incubazione varia dai 3 ai 70 giorni.
Ma una delle strategie batteriche più difficoltose da fronteggiare è la capacità della Listeria monocytogenes di creare un biofilm al di sotto del quale le cellule crescono ben protette da quasi ogni stress ambientale incluso lo stress chimico da disinfettanti specifici. La persistenza su varie superfici industriali può, così, protrarsi per anni.
Il sistema enzimatico che può tenere in scacco Listeria monocytogenes: lo studio
Requisito fondamentale per un patogeno alimentare deve essere una spiccata resistenza ad ambienti acidi: possono incorrervi sia in ambienti sottoposti costantemente a disinfezione, sia nel passaggio gastrico, che precede la colonizzazione intestinale. Per far fronte alla notevole sfida esistenziale rappresentata dall’acidificazione, i batteri sfruttano un meccanismo complesso: il sistema della glutammato decarbossilasi o sistema GAD. Tale strutturata architettura enzimatica è rintracciabile in tutti i regni viventi e dimostra di presiedere a svariate funzioni.
Il sistema GAD, infatti, non interviene solo nella resistenza all’acidificazione del mezzo: fa parte del sistema nervoso animale e del meccanismo biochimico che difende le piante dall’anossia. Presente anche in microrganismi diversi, come E. coli e Francisella tularensis, può essere strutturato in modo diverso da specie a specie.
In L. monocytogenes, il sistema GAD si compone di 3 enzimi, ovvero le glutammato decarbossilasi (GadD1, GadD2, GadD3), e di 2 antiporti glutammato/GABA (GadT1 e GadT2 in Fig.2).
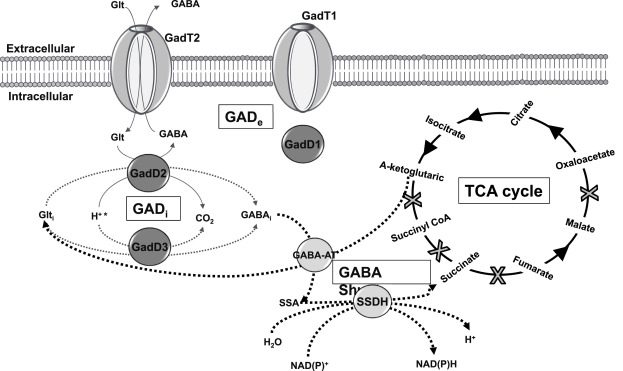
Sistema GAD e regolazione del pH batterico
Il ciclo biochimico guidato dal sistema GAD ha inizio quando una molecola di glutammato extracellulare (Glt-e) viene importata nella cellula batterica. In realtà questo ingresso comporterà l’uscita di un’altra molecola, per antiporto. Ma, per ora, torniamo al glutammato: appena entrato nel corpo cellulare, esso viene decarbossilato da un enzima opportuno (decarbossilasi). Mediante sostituzione del gruppo α-carbossilico con un protone, si formerà acido γ-amino-butirrico o GABA. Proprio il GABA sarà la molecola scambiata in antiporto con il glutammato per alimentare il ciclo di reazioni. Il consumo di un protone, durante la decarbossilazione del glutammato extracellulare, migliora il pH citoplasmatico, attenuando lo stress acido.
Quando la cellula batterica è esposta a pH troppo bassi, il sistema GAD converte una molecola di glutammato extracellulare in GABA extracellulare. Si consuma, così, un protone intracellulare. L’effetto finale è la riduzione della concentrazione protonica nella cellula, alleviando l’acidificazione del citoplasma. Inoltre, gli enzimi del GAD possono utilizzare glutammato intracellulare (Glt-i), per aumentare ulteriormente il pH citoplasmatico. In L. monocytogenes, l’enzima GadD3, per esempio, non è associato ad alcun antiporto e si ritiene che sia responsabile dell’utilizzo del glutammato intracellulare da parte della cellula batterica.
Il GABA intracellulare prodotto dal sistema GAD, viene poi catabolizzato a succinato attraverso la via dello shunt del GABA. Tale via enzimatica è articolata in due tappe, catalizzate da GABA-aminotransferasi e succinato-semialdeide-deidrogenasi.
Quante funzioni può svolgere il GAD a seconda della specie batterica?
Il contributo del sistema GAD intracellulare alla tolleranza acida dipende, però, dal ceppo batterico. In L. monocytogenes EGD-e, esso gioca un ruolo cruciale nell’acido-resistenza, mentre in altre specie microbiche ha solo un ruolo collaterale. Nelle piante, la produzione del GABA è associata a molti tipi di stress: meccanico, salino, termico o da congelamento. Il sistema GAD è, inoltre, presente nel cervello dei mammiferi, dove il GABA prodotto assolve alla funzione di neurotrasmettitore inibitorio. In molti organismi, come F. tularensis e Saccharomyces cerevisiae, la presenza del sistema GAD è associata ad un’adeguata risposta allo stress ossidativo.
Il meccanismo esatto non è ancora completamente chiarito. Tuttavia, la maggior parte degli studi suggerisce che alterazioni del sistema GAD conducano ad una diminuzione degli intermedi di reazione del ciclo degli acidi tricarbossilici (TCA), di NADPH e glutatione. Tutte molecole dall’elevato potere anti-ossidante, delle quali il batterio non potrebbe quindi più giovarsi.
In L. monocytogenes, probabilmente a causa del ruolo nell’acido-resistenza, non si è ancora accertato del tutto se il sistema GAD possa mediare la risposta ad altri tipi di stress, oltre a quello da nisina (unico antibiotico ammesso nei cibi). Quest’ultimo è garantito dall’enzima GadD1 del ceppo L. monocytogenes L028.
Metodo sperimentale e ceppi di Listeria coinvolti
Lo studio condotto da Marcia Boura e colleghi ha coinvolto diversi ceppi batterici del genere Listeria: i wild-type EGD-e, 10403S ed L028, ma anche i loro mutanti isogenici, rispetto a geni che codificano per il sistema GAD. Le colture cellulari di stock, conservate a -80°C in dimetilsolfossido (DMSO 15% v/v), sono state strisciate su piastre di agar cuore-cervello (BHI) ed incubate a 37°C overnight.
A crescita cellulare avvenuta, i ricercatori hanno prelevato una colonia rispettivamente dei ceppi EGD-e e 10403S e l’hanno trasferita in 3 mL di brodo BHI sterile. Una colonia di L028, invece, è stata passata in brodo di soia triptico arricchito con 0.6% w/v di estratto di lievito (TSBY). Ogni inoculo ha subìto incubazione a 37°C sotto agitazione (120 rpm).
L. monocytogenes è cresciuto in una notte nei differenti brodi di coltura contenenti concentrazioni sub-letali di H2O2 (0.01%) ed i ricercatori hanno misurato la densità ottica (O.D.) a 620 nm ogni 20 minuti (Sunrise plate reader – Tecan, Austria). Il modello di valutazione dei parametri di crescita, come lunghezza della fase di latenza (lag phase), tasso di crescita e massimo di O.D., ha fatto riferimento al lavoro di Baranyi e Roberts.
Saggio di diffusione radiale su terreno solido con H2O2
I ricercatori hanno, inoltre, diluito le colture liquide (post-incubazione overnight in agitazione) fino ad un OD600nm di 0.2. Contestualmente, essi hanno prelevato 100 μL di sospensione e li hanno seminati su Mueller-Hinton agar (MHA). Su questo, essi hanno anche posto dischetti di carta da filtro Whatman 3MM (diametro 0.7 cm) imbevuti di H2O2 al 30% v/v (pipettandone 10 μL). L’incubazione è durata 18 ore ad una temperatura di 37°C. Tale saggio ha coinvolto sia i ceppi di L. monocytoges wild type (WT) che i loro rispettivi mutanti con delezioni su differenti geni gad (Δgad).
L. monocytogenes 10403S ΔgadD3 ha mostrato una marcata riduzione di CFU/ml (4.6 log) in presenza di H2O2, rispetto al WT. L. monocytogenes EGD-e ha evidenziato riduzione della resistenza allo stress ossidativo solo nei mutanti ΔgadD2 and ΔgadD3 (0.5 log di riduzione CFU/ml). Il ceppo L. monocytogenes LO28 ha, invece, dimostrato sensibile abbattimento della resistenza ossidativa solo per il mutante ΔgadD1 (5.67 log di riduzione CFU/ml).
Nel saggio di diffusione su H2O2, dunque, solo L. monocytogenes EGD-e mutanti ΔgadD2 and ΔgadD3 hanno fornito le più larghe zone di inibizione di crescita rispetto al WT. Tutti gli altri mutanti non hanno, invece, subìto la agognata riduzione di crescita sotto stress ossidativo.
Sensibilizzazione della Listeria
La resistenza allo stress ossidativo è cruciale per la sopravvivenza di L. monocytogenes nei cibi, negli ambienti di preparazioni alimentari o per la loro stessa patogenicità. La ricerca impiega e studia varie tecniche di disinfezione (ozonizzazione, plasma freddo, sonicazione), cercando di eliminare microbi e patogeni. Ottenere una sensibilizzazione allo stress ossidativo, mortale per i batteri, sarebbe l’anello che chiude i protocolli alimentari. Lì dove il plasma freddo e la sonicazione non possono arrivare.
In questo studio, i ricercatori hanno dimostrato che l’ipersensibilità allo stress ossidativo di mutanti di L. monocytogenes ΔsigB corrisponde ad una proliferazione intracellulare simile al WT. SigB è, infatti, il gene regolatore della sensibilità all’ossidazione del genere Listeria. La stimolazione del sigB incrementa, di fatto, la generale resistenza a stress multipli; ciò non di meno, questo si fa sentire soprattutto nella modulazione dell’ipersensibilità ossidativa: mediante una più bassa attività della catalasi.
Saggio della Catalasi
I ricercatori, in questo studio, hanno condotto il test della catalasi con approccio visivo. La degradazione di H2O2 da parte dell’enzima, infatti, produce H2O ed O2 molecolare, rilasciato sotto forma di bolle. Secondo Iwase et al., la quantità di bolle è direttamente proporzionale all’attività catalasica. Ridotta capacità enzimatica si è rivelata solo per il mutante L. monocytogenes EGD-e ΔgadD3, rispetto al WT.
I nuovi studi, come quello appena argomentato, ritengono che il sistema GAD possa mediare l’effetto del gene sigB, per la sensibilità ossidativa, attraverso le modulazioni dell’attività della catalasi.
Riferimenti bibliografici
- https://www.sciencedirect.com/science/article/pii/S0740002019306665
- https://www.sciencedirect.com/science/article/abs/pii/S0168160519303162
- https://www.mdpi.com/1420-3049/25/4/792
- https://jb.asm.org/content/early/2020/01/15/JB.00692-19.abstract
- https://sfamjournals.onlinelibrary.wiley.com/doi/abs/10.1111/j.1365-2672.1996.tb03559.x
- https://onlinelibrary.wiley.com/doi/abs/10.1002/path.1700290409
- https://onlinelibrary.wiley.com/doi/full/10.1046/j.1365-2958.2001.02398.x
- https://aem.asm.org/content/78/10/3571.short
- https://www.sciencedirect.com/science/article/abs/pii/0168160594901570
- https://www.microbiologiaitalia.it/immunologia/il-braccio-armato-del-microbiota-contro-cancro-ed-infezioni/