Premessa
La sindrome dell’intestino irritabile (IBS) è un disturbo gastrointestinale che colpisce il 10-20% della popolazione e costituisce almeno il 50% dei casi riferiti dai gastroenterologi. Rispetto alle malattie infiammatorie croniche intestinali (le cosiddette MICI) quali il morbo di Crohn e la colite ulcerosa, lo studio relativo all’alterazione del microbiota intestinale nei pazienti con IBS è meno documentato.
Generalmente, la composizione del microbiota intestinale di individui sani è relativamente stabile; i cambiamenti nella comunità microbica possono portare ad uno squilibrio noto come disbiosi. I disturbi all’ecosistema microbico intestinale che hanno portato alla disbiosi possono causare malattie del tratto gastrointestinale (GIT), e la ricerca attuale suggerisce che lo stato di disbiosi abbia un ruolo potenziale nell‘IBS.
Numerose ricerche hanno iniziato a dimostrare il ruolo importante del microbiota intestinale nella genesi dell’IBS.
Nell’ultimo decennio, in studi epidemiologici condotti su pazienti con IBS post-infettiva, il riscontro di un’alterazione del microbiota del tratto gastrointestinale è stato proposto come una delle possibili cause di IBS. Inoltre, anche la terapia antibiotica utilizzata per il trattamento delle infezioni extra-intestinali, può alterare il microbiota intestinale, ed è significativamente associato con l’IBS.
Tuttavia, i dati sull’associazione tra specifici gruppi batterici ed IBS sono spesso contrastanti e ancora non definitivi. Questo articolo si propone di fare una sintetica revisione sulle prove a sostegno di questa associazione.
L’IBS
L’IBS è un disordine gastrointestinale funzionale, fonte di notevole disagio per molti soggetti e potenzialmente invalidante per alcuni con un impatto considerevole sulla spesa e sull’organizzazione sanitaria così come sulla qualità della vita di chi ne soffre.
Inoltre, ha significative ripercussioni sul piano socio-economico generale, in considerazione della riduzione della produttività legata alle assenze dal lavoro causate dai sintomi gastrointestinali sperimentati che producono non pochi disagi ai soggetti che ne soffrono.
La sindrome dell’intestino irritabile (IBS) è una patologia comune ma difficile da trattare. Nella più recente versione dei Criteri di Roma IV, questi quadri gastroenterici sono stati ridefiniti come “disordini dell’interazione intestino-cervello” (disorders of gut-brain interaction o DGBI) e, conseguentemente, anche l’approccio alla loro gestione è stato rivisto.
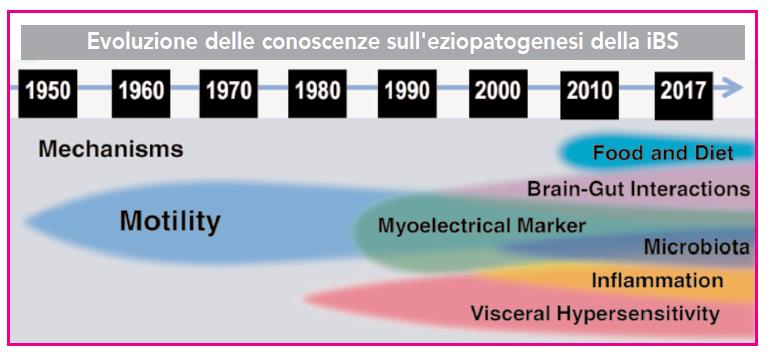
Quest’ultima definizione tiene conto, in base alle nuove scoperte, dei fattori che concorrono all’insorgenza della sindrome del colon irritabile tra cui il microbiota intestinale e l’asse microbiota-intestino-cervello.
Tra gli altri fattori eziopatogenetici coinvolti nell’insorgenza e nel peggioramento della IBS sono ritenuti particolarmente rilevanti e potenziali obiettivi del suo trattamento:
- l’aumento della permeabilità della barriera intestinale, con conseguente maggiore penetrazione di composti tossici o sensibilizzanti assunti con gli alimenti o derivati dal metabolismo del microbiota intestinale;
- l’eccessiva sollecitazione del sistema immunitario locale a livello della sottomucosa intestinale e la successiva attivazione di vie neurali da cui dipende la regolazione della funzionalità gastroenterica (motoria e secretiva), nonché la sensibilità viscerale;
- la predisposizione genetica, basata sui polimorfismi di geni coinvolti nell’attivazione immunitaria, nella definizione delle caratteristiche della barriera intestinale e nell’interazione con il microbiota residente;
- fattori endocrini e neuroendocrini del tratto gastroenterico (in particolare, relativi all’alterato rilascio intestinale di serotonina, sia a digiuno sia in fase post-prandiale);
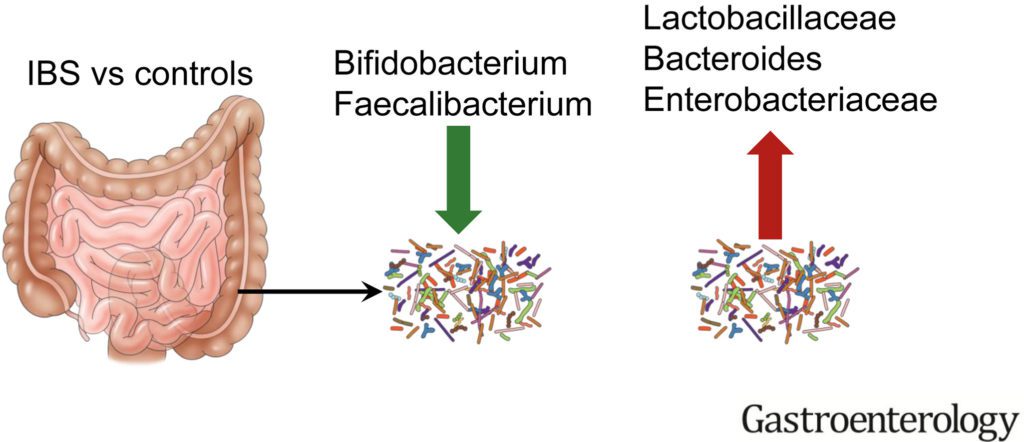
- l’abbondanza e la composizione del microbiota intestinale, che in chi soffre di IBS mostra caratteristiche distintive correlabili alla sintomatologia lamentata dai pazienti (in particolare, l’aumento del rapporto tra Firmicutes/Bacteroides, la riduzione dei Bifidobacteria e dei Faecalibacterim ed una diminuita diversità di specie).
Studi sul rapporto tra microbiota e IBS
Il ruolo del microbiota, della risposta infiammatoria e immunitaria della mucosa intestinale nell’insorgenza e nella persistenza dei sintomi dell’IBS è supportato dall’osservazione che le gastroenteriti virali, batteriche o da protozoi, che destabilizzano fortemente la microflora dell’ospite, costituiscono un importante fattore di rischio per lo sviluppo di una particolare forma di IBS, chiamata IBS post-infettiva (IBS-pI).
Lo studio più completo del microbiota luminale nell’IBS è stato effettuato sul microbiota fecale di 27 pazienti con IBS e 22 controlli sani utilizzando come tecnica identificativa la PCR-RT. Sono stati effettuati confronti tra i sottotipi fenotipici dell’IBS: predominante nella diarrea (IBS-D), predominante nella costipazione (IBS-C) e IBS alternato (IBS-M).
Analizzando i vari studi condotti sembra esserci il tema coerente di una riduzione relativa dei lattobacilli e dei bifidobatteri nei campioni fecali di pazienti con IBS e concentrazioni più elevate di specie come enterobatteri, coliformi e batteroidi.
Il genere Bifidobacterium appare significativamente ridotto nei pazienti con IBS e viene considerato un genere “protettivo” in grado di migliorare il quadro sintomatologico dell’IBS.
Questa osservazione è supportata da uno studio controllato su 44 pazienti adulti in doppio cieco (22 trattati e 22 con placebo) in trattamento per 6 settimane con Bifidobacterium longum NCC3001 in soggetti con IBS con sintomi di ansia e/o depressione, che ha concluso che questo batterio può ridurre i punteggi della depressione e migliorare la qualità della vita nei pazienti affetti diminuendo i livelli di 4-cresolosolfato, sostanza prodotta dalla interazione batterica con l’ospite e che influenza la produzione di dopamina causando depressione.
Esattamente come il sistema nervoso, il microbiota enterico è in grado di modulare la motilità intestinale. Ad esempio, Bifidobacterium bifidum e Lactobacillus acidophilus sono in grado di promuovere la motilità, mentre le specie di Escherichia possono inibirlo.
I prodotti metabolici dei batteri intestinali, come gli acidi grassi a catena corta (SCFA) o i peptidi chemiotattici sono in grado di stimolare il sistema nervoso enterico e influenzare il transito intestinale. La rottura dell’equilibrio che esiste tra diverse popolazioni di microbiota intestinale potrebbe quindi predisporre l’ospite ad una motilità intestinale alterata, che si traduce nella sintomatologia diarroica o stiptica. Questi cambiamenti, a loro volta, possono influenzare l’equilibrio del microbiota enterico.
Anche il genere Bacteroides è stato riscontrato in aumento nei pazienti con IBS, specialmente nei pazienti con la forma di IBS-D. Questo può essere dovuto a un’infiammazione di basso grado indotto da alcune specie, compresi i ceppi enterotossigeni di Bacteroides fragilis.
La tossina di Bacteroides fragilis può dissolvere le glicoproteine della mucosa, influenzando così il microambiente e la motilità intestinale, che può causare il dolore addominale e la diarrea. Molto interessante risulta la scoperta di un ruolo potenzialmente “protettivo” nei pazienti con IBS del genere Faecalibacterium, soprattutto Faecalibacterium prausnitzii, associato al mantenimento in buono stato della mucosa intestinale.
Questo batterio è considerato il principale produttore di butirrato che porta alla riduzione dei sintomi di IBS attraverso la mediazione di interleuchina-17 ed il mantenimento dell’integrità della barriera. Un’altra evidenza è che il genere Bifidobacterium è sempre ridotto in maniera significativa nei pazienti con IBS indipendentemente dal sottotipo di IBS.
Un’altra osservazione fatta è quella che, rispetto ai controlli sani, i pazienti con IBS presentano una ridotta quota degli archeobatteri produttori di metano, come per esempio Methanobrevibacter smithii (94% del totale dei metanobatteri di norma presenti nell’intestino). In aggiunta, è stato riportato che la produzione di metano è diminuita nei pazienti con IBS-D e aumentata in chi presenta IBS-C.
La capacità della microflora endogena di rimuovere l’eccesso di idrogeno e di produrre metano è stata associata a un ridotto tempo di transito intestinale e a effetti antinfiammatori a livello del colon. La diminuita abbondanza di batteri metanogeni nell’intestino di chi soffre di IBS comporterebbe, quindi, una minore capacità di eliminare l’idrogeno intestinale con conseguente maggiore propensione al gonfiore addominale e alla flatulenza.
Nei pazienti con IBS è stata riscontrata anche una diminuzione dell’abbondanza delle specie batteriche produttrici di butirrato, soprattutto nei soggetti interessati da IBS-D e IBS-M. Dal momento che questo SCFA esercita funzioni protettive sulla mucosa intestinale, supportandone l’integrità e la funzionalità e contrastandone l’infiammazione, la riduzione dei microrganismi che lo producono potrebbe giustificare una maggiore propensione alle alterazioni della permeabilità dell’epitelio intestinale, con conseguente aumento dell’infiammazione, della sollecitazione della risposta immunitaria e della sensibilità viscerale (attivazione dei nocicettori e disregolazione del sistema nervoso enterico), a loro volta all’origine di difetti dell’assorbimento, dell’alterata motilità enterica e del dolore addominale tipici dell’IBS.
Altre alterazioni del microbiota frequentemente riscontrate nei pazienti con IBS rispetto ai controlli sani riguardano l’incremento dell’abbondanza dei Proteobacteria (compresi ceppi del phyla Veillonella) e dei Firmicutes (compresi alcuni ceppi di Lactobacillus e Ruminococcus), generalmente accompagnato dalla diminuzione della quantità di Bifidobacterium, Faecalibacterium ed Erysipelotrichaceae.
Ulteriori analisi hanno evidenziato che i pazienti che presentano IBS-D sono caratterizzati da una significativa diminuzione dei Lactobacillus e dei Bifidobacterium intestinali rispetto ai controlli sani. Altri studi hanno, invece, segnalato nei pazienti con IBS un incremento di Pseudomonas aeruginosa, Entrobacteriaceae (come Ruminococcus spp., Lactobacilli spp., and Clostridium spp.).
Il ruolo delle disbiosi nell’eziopatogenesi dell’IBS è avvalorato dal riscontro di IBS-post infettiva (IBS-pI) nel 10-20% dei soggetti che sperimentano gastroenteriti sostenute da batteri, virus e parassiti intestinali come il protozoo flagellato Giardia duodenalis. In caso di infezioni intestinali da Clostridium difficile, l’IBS-pI si può sviluppare anche nel 25% dei casi, alcuni mesi dopo la guarigione.
Dopo infezioni da C. difficile e altri batteri l’aumentato stato infiammatorio intestinale è stato oggettivato dall’incremento di proteina C reattiva (PCR) e delle citochine infiammatorie come IL-6 e IL-8, nonché dall’inibizione selettiva dei mastociti in presenza di lipopolissacaridi microbici (LPS). Dopo infezioni intestinali da Streptococcus spp., invece, sono stati evidenziati aumentati livelli di IL-6 ed una maggiore abbondanza di batteri in grado di degradare la mucina, come Ruminococcus spp.
Ulteriori prove a supporto del ruolo chiave del microbiota intestinale e delle sue alterazioni nell’insorgenza della IBS viene dal riscontro di un aumentato rischio di IBS dopo una terapia antibiotica per bocca e dall’evidenza clinica di un generale miglioramento dei sintomi gastrointestinali e del transito nei pazienti con IBS che assumono probiotici.
Alterazioni del microbiota intestinale potrebbero partecipare all’insorgenza e al peggioramento della sintomatologia della IBS anche a causa del ruolo della flora endogena nel metabolismo degli acidi biliari, indispensabili per la digestione e l’assorbimento dei grassi alimentari e delle vitamine liposolubili e implicati in diversi meccanismi fisiologici rilevanti nei DGBI (motilità e secrezioni intestinali, permeabilità della mucosa, sensibilità viscerale ecc.), nonché in grado di influenzare diverse vie metaboliche.
Gli acidi biliari hanno anche effetti antibatterici e immunostimolanti e giocano un ruolo rilevante nella prevenzione della sovra-crescita batterica nell’intestino tenue (SIBO) una particolare forma di disbiosi caratterizzata dall’eccessiva proliferazione nell’ileo e nel digiuno di batteri di norma residenti in altre parti del tratto enterico.
La SIBO si associa a sintomi come gonfiore addominale, meteorismo, alterato assorbimento e diarrea ed è stata riscontrata nei pazienti con IBS-D, soprattutto in quelli con malassorbimento degli acidi biliari. Inoltre, un alterato metabolismo degli acidi biliari legato a particolari composizioni del microbiota del colon può essere implicato nell’eziopatogenesi e nella sintomatologia della IBS-C, dal momento che ridotti livelli di acidi biliari in questo tratto dell’intestino sono apparsi associati a stipsi e aumento del tempo di transito. Questo esito potrebbe dipendere dalla solfatazione degli acidi biliari da parte del microbiota.
Probiotici e IBS
Sono stati analizzati i benefici clinici prodotti da interventi suscettibili di modificare il microbiota intestinale nei pazienti con IBS e disturbi correlati; questi interventi comprendono antibiotici, prebiotici e probiotici.
I probiotici hanno mostrato effetti positivi sui fattori implicati nella fisiopatologia dell’IBS come infezione enterica, funzione di barriera intestinale alterata, ipersensibilità viscerale, alterazioni della motilità, risposte aberranti nell’asse cervello-intestino, funzioni cerebrali e risposta immunitaria locale e sistemica. Anche gli antibiotici come la rifaximina hanno dimostrato di produrre effetti consistenti, seppur modesti, in pazienti con IBS.
Ci sono stati alcuni rapporti, inoltre, sulla capacità dei probiotici somministrati per via orale di accelerare o rallentare il transito colico, influenzare l’attivazione del cervello ed il livello delle citochine circolanti. In uno studio controllato in doppio cieco effettuato su 25 pazienti con IBS (stabilita con i criteri di Roma IV) trattati con probiotici e placebo, sono stati valutati sintomi, abitudini intestinali, gravità della malattia, permeabilità intestinale, microbiota intestinale al tempo 0, 30, 45, 60 giorni dall’inizio.
I risultati sono stati una netta riduzione dei sintomi (dolore e gonfiore addominale), miglioramento della permeabilità intestinale (con test al sucralosio), aumento della concentrazione fecale di lattobacilli e bifidobatteri, evidenziando quindi un netto miglioramento della gravità della malattia.
In un altro studio su 20 soggetti italiani sani (8 uomini e 12 donne) sono stati somministrati per un periodo di un mese due ceppi: Lactobacillus rhamnosus HN001 e Bifidobacterium longum BB536 per valutare la capacità di colonizzare l’ambiente intestinale e modificare la composizione del microbiota residente.
A distanza di un mese la concentrazione dei due ceppi è aumentata nella maggior parte dei soggetti e questo è stato riscontrato anche dopo un mese dalla sospensione dell’assunzione orale dei probiotici. A livello di phyla è stata rilevata una significativa riduzione del numero di Proteobacteria e Firmicutes dopo un mese di assunzione di Lactobacillus rhamnosus HN001 e Bifidobacterium longum BB536 rispetto ai campioni raccolti prima della somministrazione dei probiotici.
Nel caso dell’IBS-C, caratterizzata da costipazione prevalente, e dell’IBS-M, caratterizzata dall’alternanza di stipsi e diarrea, numerosi studi hanno evidenziato l’utilità clinica di formulazioni probiotiche contenenti lattobacilli e bifidobatteri nel migliorare il transito intestinale e, soprattutto, nell’attenuare il dolore addominale e il gonfiore.
Risultati favorevoli contro la costipazione associata alla IBS sono stati ottenuti anche con preparati simbiotici, contenenti sia batteri probiotici sia substrati prebiotici, ossia fibre o carboidrati di origine vegetale che vengono fermentate da batteri del microbiota endogeno o dai probiotici contestualmente assunti, promuovendone il metabolismo e la proliferazione e supportando effetti favorevoli per l’ospite.
I principali prebiotici in commercio comprendono i frutto-oligosaccaridi (FOS), i galatto-oligosaccaridi (GOS), l’inulina, il lattulosio, l’amido resistente (SR). Molti ceppi di lattobacilli e bifidobatteri sono in grado di fermentare i FOS, producendo SCFA, dotati di effetti antinfiammatori e protettivi della mucosa intestinale, nonché in grado di determinare ulteriori azioni favorevoli grazie alla modulazione del metabolismo degli acidi biliari.
L’assunzione di probiotici e/o prebiotici è sicura e generalmente ben tollerata e può essere proposta in tutti i casi in cui siano presenti sintomi di IBS o correlabili a disbiosi intestinali di qualunque origine (anche post-infettiva).
Il riscontro di benefici a livello enterico nei pazienti con IBS può, tuttavia, essere variabile in considerazione dell’unicità della composizione del microbiota basale individuale, delle sue interazioni dinamiche con l’ospite e del diverso contributo degli innumerevoli fattori patogenetici nello sviluppo e nella persistenza della IBS nel singolo paziente. I risultati di un piccolo numero di studi clinici suggeriscono che l’assunzione regolare di alcuni batteri probiotici aiuta a trattare i sintomi dell’IBS, come gonfiore, distensione addominale visibile e alterazioni delle abitudini intestinali.
Conclusioni
Numerosi studi hanno ormai chiaramente evidenziato l’esistenza di peculiarità di composizione e abbondanza del microbiota intestinale dei pazienti affetti da IBS, nonché la frequente presenza di disbiosi, cui è stato attribuito un rilevante ruolo eziopatogenetico nel contesto di una sindrome che resta, in tutti i casi, di natura multifattoriale.
In questo contesto, è stata riconosciuta una particolare rilevanza agli aspetti legati alla dieta, all’equilibrio del microbiota intestinale e alle sue interazioni con l’ospite, nonché all’impiego di prodotti probiotici e prebiotici in grado di influenzare favorevolmente composizione e metabolismo della microflora endogena.
I dati evidenziano l’eterogeneità del microbiota nei pazienti con IBS; tuttavia, risulta chiaro che alcuni batteri possono essere utili nel trattamento IBS.
Un intervento “nutrizionale” più mirato per la gestione della IBS è rappresentato dai prodotti probiotici, ossia formulazioni contenenti microrganismi sicuramente non patogeni per l’uomo che, se assunti in quantità adeguata, sono in grado di arrivare vivi e vitali nell’intestino e di colonizzarlo almeno temporaneamente, influenzando positivamente sull’equilibrio del microbiota endogeno e il benessere dell’ospite. Appare quindi evidente che la gestione del paziente con IBS dovrebbe prevedere oltre che i trattamenti farmacologici, la dieta e le modificazioni degli stili di vita, anche strategie rivolte al microbiota intestinale.
Giuseppe Chindemi
Fonti
- Bonfrate L., Di Palo D.M., Celano G., Albert A., Vitellio P., De Angelis M., Gobbetti M., Portincasa P. “Effects of Bifidobacterium longum BB536 and Lactobacillus rhamnosus HN001 in IBS patients” first published:21 January 2020 https://doi.org/10.1111/eci.13201
- Chong P.P. et al. “The Microbiome and Irritable Bowel Syndrome – a review on the pathophysiology, Current research and Future therapy”. Front Microbiol 2019; 10:1136.
- Pinto-Sanchez M.I., Hal G.B., Ghajar K., Collin S.M., Moayyedi P. Berci P. “Probiotic Bifidobacterium longum NCC3001 Reduces Depression Scores and Alters Brain Activity: A Pilot Study in Patients With Irritable Bowel Syndrome” Gastroenterology 2017;153:448-459.
- Pittayanon R., Lau J.T., Yuan Y., Leontiadis G.I., Tse F., Surette M., and Moayyedi P. “Gut Microbiota in Patients With Irritable Bowel Syndrome: A Systematic Review” Gastroenterology 2019;157:97–108.
- Toscano M., De Grandi R., Stronati L., De Vecchi E., DragoL. “Effect of Lactobacillus rhamnosus HN001 and Bifidobacterium longum BB536 on the healthy gut microbiota composition at phyla and species level: A preliminary study Basic Study” World J Gastroenterol2017 April 21; 23 (15): 2696-2704.
Buongiorno Dr. Chindemi. Ho letto con interesse il suo articolo e mi chiedevo se potesse consigliarmi il miglior prodotto per l ibs che comporta purtroppo alitosi, bruciori di stomaco, stitichezza e depressione. Sono già in cura da anni con PPI per lo stomaco e cipralex per altri fatti, ma credo di aver bisogno di un aiuto in più.
La ringrazio anticipatamente, cordiali saluti Chiara
Buongiorno DR. CHINDEMI.
Ho una curiosità relativa a quali integratori scegliere in caso di IBS.
Un nutrizionista mi ha consigliato di seguire la dieta a basso contenuto di FODMAP per alleviare i sintomi di IBS. I FOS sono altamente sconsigliati nella dieta FODMAP.
Allo stesso tempo, leggendo il suo articolo e cercando quali integratori associare alla corretta dieta al fine di ridurre i sintomi di IBS, ho notato che molti probiotici consigliati per IBS sono integrati con prebiotici tipicamente di tipo FOS.
Non capisco perché definire una dieta FODMAP a bassa presenza di FOS e, contemporaneamente, assumere integratori che, oltre ai probiotici, contengono anche FOS. Mi sfugge qualcosa?
Grazie,
Gabriele.