Premessa
Vi sono pochi dubbi sul fatto che il sistema immunitario dell’uomo dipenda strettamente dalle istruzioni che riceve continuamente dal suo microbiota, ovvero dalla ricchissima comunità di microrganismi che vivono in simbiosi con il nostro corpo.
D’altra parte, il ruolo centrale del microbiota intestinale nello sviluppo del sistema immunitario e nella modulazione della sua funzione non sorprende, ricordando che la mucosa intestinale è la più ampia superficie dell’organismo a contatto con microbi che hanno un’interazione diretta e intensa con la mucosa e con i suoi sistemi di difesa.
Si è visto infatti che quando questa comunità di simbionti perde in ricchezza e diversità, e va incontro a quel processo che viene definito disbiosi, il sistema immunitario dell’ospite inizia a perdere di efficacia e precisione al punto da reagire in maniera incongrua, per eccesso o per difetto, o talora contro un bersaglio errato (come si verifica nelle malattie autoimmuni) e questo pone l’attenzione sul possibile rapporto tra microbiota e malattie autoimmuni.
Oggi sappiamo che è possibile ricolonizzare progressivamente un intestino che si trovi in uno stato di disbiosi in maniera tanto più rapida quanto più lieve è il dismicrobismo di partenza.
Pertanto possiamo dire che, fin dai primi giorni di vita di un individuo, disponiamo di un’arma efficace che ci permette di potenziare efficacemente il nostro sistema immunitario guidandolo nella sua maturazione.
Le malattie autoimmuni ed il microbiota
In caso di disbiosi il microbiota fa da trigger (ossia innesco) di numerose patologie.
In condizioni fisiologiche il microbiota e l’individuo sono in rapporto di simbiosi: da una parte il microbiota aiuta l’ospite a digerire carboidrati, a sintetizzare vitamine, a prevenire la colonizzazione di batteri patogeni ed a sviluppare il tessuto linfoide gastrointestinale (GALT), coinvolto nelle difese immunitarie; dall’altra l’individuo offre i nutrienti necessari alla sopravvivenza del microbiota.
Se questa relazione viene compromessa per alterazione dei batteri, il microbiota contribuisce allo sviluppo di malattie autoimmuni, mediante alterazione della barriera intestinale, infiammazione e interazione tra batteri intestinali e cellule immunitarie.
Tale alterazione è stata associata a diverse patologie autoimmuni, tra cui le malattie infiammatorie croniche dell’intestino quali il morbo di Crohn e la colite ulcerosa, ma anche a malattie non legate all’intestino come l’artrite reumatoide, il diabete 1 o il lupus eritematoso sistemico. Alla luce degli studi attuali, il microbiota sembrerebbe essere fortemente implicato nell’insorgenza di:
- sclerosi multipla
- lupus
- artrite reumatoide
- colite ulcerosa
- tiroidite autoimmune di Hashimoto
- morbo di Basedow
- morbo di Crohn
- fibromialgia
- diabete di tipo 1
- celiachia
Il microbiota ha un filo diretto con il sistema immunitario, grazie all’azione combinata e perfettamente equilibrata delle due classi di microrganismi che lo compongono: i simbionti che utilizzano l’intestino per crescere e svilupparsi, ma che nello stesso tempo rilasciano molecole fondamentali per il nostro benessere (alcune vitamine e gli acidi grassi a catena corta), ma soprattutto sostanze antinfiammatorie che aumentano la nostra “tolleranza immunitaria” e i patobionti, batteri che allenano il sistema immunitario, facendogli da palestra, per prepararlo a difendersi e a combattere gli agenti patogeni.
Se, complice un’alimentazione sbagliata, l’equilibrio del microbiota va in tilt ecco che al suo interno aumentano quelle specie in grado di produrre sostanze pro-infiammatorie che ingannano il sistema immunitario, orientandolo, se c’è già una predisposizione genetica, ad armarsi contro l’organismo stesso, invece che contro i reali nemici che mettono a rischio la salute.
La sindrome dell’intestino permeabile (leaky gut syndrome)
L’alterazione della permeabilità intestinale, detta anche “leaky gut syndrome”, è oggi fortemente sospettata di essere l’origine di tutte le malattie autoimmuni.
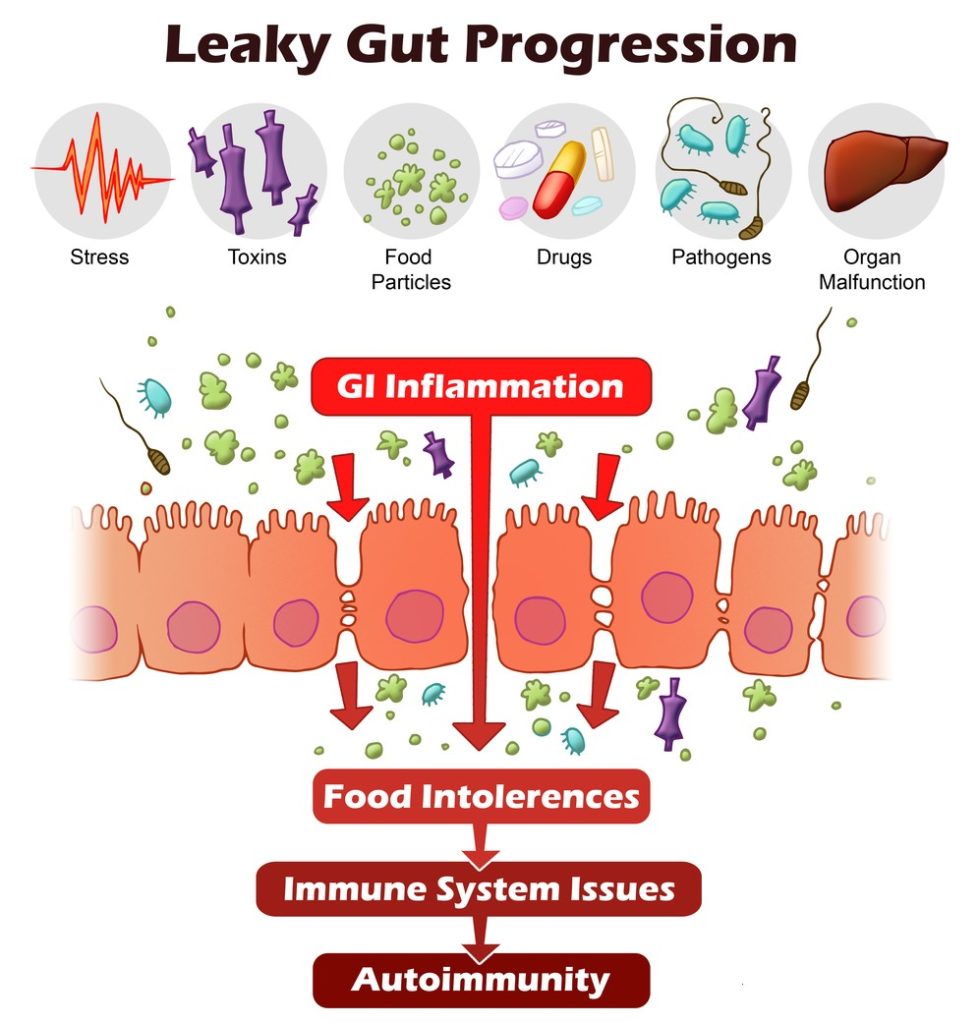
La superficie intestinale è formata da cellule che sono strette e vicinissime tra di loro, con giunzioni serrate (tight junction), al fine di fungere da barriera selettiva ed impedire il passaggio indiscriminato di sostanze dall’intestino al sangue e ai tessuti sottostanti.
Quando il microbiota è equilibrato, tutto funziona perfettamente e la membrana intestinale svolge adeguatamente il proprio lavoro, lasciando passare al sangue ed ai tessuti sottostanti solo ciò che serve.
Quando, invece, si crea una condizione di disbiosi, si innescano nell’intestino fenomeni infiammatori conseguenti sia alla non più adeguata azione digestiva da parte dei microrganismi in esso presenti, sia a causa dei cataboliti tossici prodotti dalla componente patogena che inizia a svilupparsi in eccesso.
A questo punto le proteine più grandi possono attraversare la parete intestinale ed entrare in circolo; quando questi peptidi entrano nel sangue, diventano i bersagli delle immunoglobuline circolanti che formano complessi immuni che penetrano nei vari tessuti, dove possono provocare infiammazione e processi degenerativi.
Lo stato infiammatorio e l’alterata permeabilità richiama in sede linfociti T che giungono per dare man forte all’infiammazione.
Sono noti come Th1 e Th17. Allo stesso tempo diminuisce il numero dei linfociti Treg che avrebbero invece il ruolo di spegnere l’infiammazione.
La diminuzione del rapporto Treg/Th17 è una costante delle malattie cronico-infiammatorie.
Studi su microbiota e malattie autoimmuni
Il microbiota svolge un ruolo fondamentale nella formazione di immunoglobuline IgA (difensori della superficie del nostro organismo da tossine e batteri patogeni), e di cellule T regolatrici (Treg, ad azione immunosoppressiva).
Nella disbiosi intestinale, causata da una dieta sbilanciata, da antibiotici, da stress psico-fisico, avvengono alterazioni nel metabolismo batterico, così come la sovra crescita di microrganismi potenzialmente patogeni; le cellule T infiammatorie, tipo Th1 e Th17 aumentano, e le cellule Treg diminuiscono.
La barriera intestinale danneggiata diventa permeabile e permette a cellule e molecole pro-infiammatorie di diffondere e andare in vari distretti.
È stato riscontrato che nelle malattie autoimmuni, il sistema immunitario è squilibrato verso uno stato infiammatorio cronico; l’aumento della permeabilità intestinale incrementa l’esposizione agli antigeni ed il rischio di produzione degli autoanticorpi.
Passando rapidamente in rassegna le principali malattie autoimmuni vediamo qualche dato che le relaziona all´azione del microbiota.
Diabete 1
Negli ultimi anni il microbiota intestinale è stato proposto come fattore principale nella patogenesi del diabete tipo 1. Il decremento del rapporto Firmicutes/Bacteroides è la condizione più descritta negli studi sull’uomo. La disbiosi sembrerebbe aumentare la permeabilità intestinale e così promuovere lo sviluppo di una nicchia pro-infiammatoria che stimola l’autoimmunità contro le β-cellule in soggetti predisposti; la disbiosi quindi sarebbe direttamente proporzionale all’intensità della patologia.

Sclerosi multipla
La dieta tipicamente occidentale peggiora la risposta autoimmune ed è, secondo ormai vari studi, in correlazione anche con la sclerosi multipla.
Uno studio più recente ha analizzato la flora batterica intestinale di pazienti con sclerosi multipla in fase di ricaduta clinica di malattia, dimostrando una riduzione intestinale di batteri del cluster di Clostridia XIV a e IV hanno mostrato di essere ridotti, entrambi formati da diverse specie batteriche che lo sono in grado di produrre SCFA come butirrato (in grado di determinare una riduzione della formazione di cellule infiammatorie Th17 ed aumento dei linfociti Treg) e la presenza di due diversi ceppi di Streptococco (Streptococcus oralis e Streptococcus mitis), che solitamente risiedono nella cavità orale e possono favorire lo sviluppo di infiammazione.
La modifica del microbiota intestinale, direttamente o indirettamente attraverso fattori dietetici, potrebbe quindi essere una potenziale opzione terapeutica per il trattamento di varie malattie, inclusa la sclerosi multipla. Promuovere l’induzione di Treg antinfiammatori e ridurre le risposte cellulari Th17 potrebbero rappresentare le più promettenti strategie nel contesto delle patologie autoimmuni.
Lupus eritematoso sistemico
Anche il lupus eritematoso è sempre più correlato alla disbiosi, cioè all’alterazione dell’equilibrio della flora intestinale (microbioma) in seguito ad un’alimentazione di tipo pro-infiammatorio che altera quell’equilibrio favorendo la permeabilità intestinale.
La grave patologia insorge a partire da una concomitanza di fattori, ma sembra che ci sia un batterio la cui presenza è sempre associata alla patologia.
Il raro batterio si chiama Enterococcus gallinarum, della specie degli enterococchi, nota perché causa grappoli infettivi e focolai d’infezione di tipo nosocomiale.
E. gallinarum, tramite la permeabilità, riesce ad entrare nell’organismo, in particolare in milza e linfonodi, scatenando un processo infiammatorio che induce la proliferazione di autoanticorpi (anticorpi che attaccano anche le cellule sane dell’organismo).
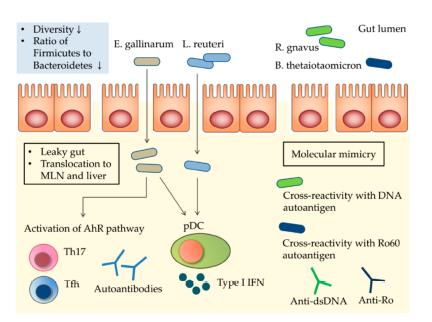
Ma è stato scoperto che l’alimentazione comprendente Lactobacillus reuteri favorisce la risposta immunosoppressiva grazie ad alcune molecole prodotte da questi batteri.
Artrite reumatoide
Sono ormai tante le evidenze scientifiche che sottolineano un netto peggioramento in relazione a una dieta pro-infiammatoria.
Quest’ultima infatti porta ad un cambiamento della tipologia di microbiota intestinale; in particolare, una dieta ricca in proteine animali, zuccheri semplici e grassi, si traduce in una ridotta diversità del microbiota.
Interventi dietetici, grassi provenienti dal pesce, riduzione nell’assunzione di proteine animali tra le altre possibili strategie, possono modificare la diversità batterica nell’intestino e condurre talvolta ad una riduzione dell’infiammazione.
Nelle persone con artrite cambiamenti del microbiota si verificano non solo nel tratto inferiore dell’intestino, ma anche nella cavità orale.
Questo rapporto è stato osservato tra malattia paradontale e artrite reumatoide precoce; infatti oltre al microbiota intestinale, è stata descritta l’associazione del microbiota orale e polmonare con la patologia della malattia. È interessante notare che, la presenza di Porphyromonas gingivalis, che è noto come batterio associato alla parodontite, nei pazienti con artrite reumatoide potrebbe avere un impatto significativo sulla patogenesi della malattia stessa.
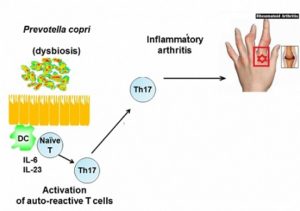
Inoltre, nell’artrite reumatoide, sono risultati aumentati Prevotella e Leptotrichia nelle feci e, all’aumento di Prevotella copri corrisponde una riduzione di molti gruppi di batteri importanti, come i Bacterioides.
Celiachia
Il consumo di glutine danneggia le pareti intestinali causando permeabilità intestinale; l’esposizione cronica alla gliadina (proteina presente nel glutine del frumento e di altri cereali) causa una down-regolazione dell’espressione di geni collegati ad una specifica proteina, la zonulina, presente nella parete intestinale a livello delle giunzioni serrate, che svolgono una funzione sigillante, ossia uniscono le due cellule adiacenti senza lasciare interstizi, in modo che le molecole idrosolubili non filtrino facilmente tra una cellula e l’altra; questo sia in soggetti celiaci che non-celiaci.
L’esposizione cronica al glutine è direttamente collegata all’aumento della permeabilità intestinale. La zonulina è una delle proteine deputate al trasferimento di alcuni soluti, dal lume all’interno dell’epitelio intestinale, quindi la sua misurazione rappresenta un buon marker della permeabilità intestinale.
Il suo aumento è stato associato all’insorgenza di varie malattie autoimmuni quali la celiachia, il diabete di tipo 1, il lupus, l´artrite reumatoide, la sclerosi multipla e la tiroidite di Hashimoto.
Rapporto tra dieta e malattie autoimmuni
Mangiare bene, (verdura, frutta, legumi, cereali integrali) consente di realizzare un buon equilibrio del microbiota intestinale.
I batteri che popolano il colon, in particolare, producono SCFA che oltre ad avere il ruolo di nutrire i colonociti sembrano promuovere la formazione di cellule T regolatorie.
Sulla nostra tavola non dovrebbero mai mancare cereali integrali, pesce, soprattutto quello azzurro che è ricco di omega-3, nutrienti che sono un po’ i “pompieri” che spengono l’infiammazione di basso grado (la cosiddetta low grade inflammation) nel nostro organismo.
Da ridurre al minimo, invece, sono gli zuccheri semplici, presenti nelle bibite gassate e nei dolciumi ed i grassi idrogenati contenuti nelle merendine, nei cibi confezionati, nei cibi da fast food.
L’aspetto di maggiore rilevanza è la necessità di assumere polisaccaridi complessi, indigeribili per l’uomo, definiti come “carboidrati microbiota-accessibili” o MAC.

Mentre il nostro genoma è carente nella trascrizione di enzimi attivi e specifici per questi carboidrati, il microbiota intestinale ne è ricco permettendo dunque la produzione di prodotti metabolici estremamente importanti per l’intestino stesso e per l’intero organismo. Non tutte le fibre sono fermentabili, ovvero non tutte sono microbiota-accessibili.
La suddetta proprietà, di essere fermentabili è attribuibile solo alla fibra solubile.
Esempi di fibre accessibili al microbiota sono il cosiddetto amido resistente che si trova principalmente nel riso, nelle patate e nell’avena che sono stati cotti e poi lasciati a raffreddare, i β-glucani presenti nelle alghe, nell’avena e nei funghi che, oltre all’impatto che hanno sul microbiota, spiccano per la loro incredibile capacità di regolare il sistema immunitario, i frutto-oligosaccaridi e l‘inulina che si trovano in aglio, cipolla, asparagi e banane, le mucillagini che troviamo nei semi di chia, semi di lino, pomodori, le pectine che abbondano nei mirtilli, ribes, limoni, mandarini, mele, arance e uva.
Le fibre solubili sono capaci di trattenere l’acqua, di gonfiarsi e di formare gel viscosi nell’intestino e, oltre ai benefici associati alla sua capacità di fermentazione, sono in grado di formare un gel capace di rallentare l’assorbimento di grassi e zuccheri.
Tale processo di fermentazione è un processo fondamentale affinché il microbiota crei sostanze come gli acidi grassi a catena corta (SCFA), che esercitano effetti positivi dal punto di vista nutrizionale, trofico, metabolico, immunitario e antinfiammatorio.
Modulazione probiotica
La strategia che, alla luce di vari lavori scientifici, dimostra maggiore efficacia in un’ottica di intervento probiotico, si basa proprio sulla caratteristica resilienza dimostrata dal microbiota (capacità adattativa che richiede tempi precisi e non certamente immediati) escludendo i fenomeni di antagonismo microbico che potrebbero scaturire dall´utilizzo di formulati che contengano, contemporaneamente, un elevato numero di specie.
La strategia elettiva dovrebbe tenere conto di un concetto chiave: un’azione di “rempiantologia microbica selettiva” che, anche per le patologie autoimmuni, preveda l’utilizzo di specie che appartengono in prevalenza ai Bifidobacterium e ai Lactobacillus.
I Bifidobacterium, mantengono serrate le giunzioni della barriera intestinale e proteggono dai patogeni mediante il rilascio di batteriocine.
I bifidobatteri, che nei primi 3 anni di vita rivestono un’importanza vitale come vera “palestra immunitaria” crescono e producono acido lattico che favorisce la crescita di batteri che producono il butirrato.
Oggi si tende ad una terapia cosiddetta “sartoriale” (si parla tanto di tailored medicine) ed in questa chiave non ha nessun razionale l´utilizzo di probiotici generici ma, sicuramente, di probiotici assolutamente specifici per sfruttare anche il fenomeno del cross-feeding ossia la produzione di metaboliti da parte di alcuni ceppi che aprono la strada per un ottimale impianto di altri.
Nel caso delle malattie autoimmuni è importante ricordare di intervenire, oltre che sul microbiota intestinale, anche sul microbiota orale alla luce della correlazione che vi è tra questo ed alcune di queste patologie.
Altro aspetto importante è il potenziamento di una azione antinfiammatoria ed il mantenimento dello stato di eubiosi.
In tal senso studi vari dimostrano come ceppi quali Lactobacillus rhamnosus LR 32, Bifidobacterium lactis BL 04, Bifidobacterium longum BL 05 e BB 536, favoriscano l’equilibrio intestinale, contribuendo alla normalità fisiologica delle mucose ed aiutino a regolare la permeabilità intestinale e a ostacolare i meccanismi che stanno alla base dei processi infiammatori.
Possiamo concludere col dire che le terapie mirate al microbiota intestinale possano dimostrarsi efficaci nella futura prevenzione o anche nella cura di numerose malattie autoimmuni.
Certamente, una migliore comprensione dell’interazione dinamica tra il microbiota intestinale e l’ospite, aiuterà a stabilire una gestione altamente personalizzata per i soggetti affetti da una malattia autoimmune e ottenere una migliore efficacia negli esiti clinici.
Interventi dietetici e probiotici mirati diventeranno probabilmente trattamenti terapeutici per le malattie autoimmuni.
Tuttavia, sono ancora necessari ulteriori studi per chiarire meglio quali alterazioni del microbiota o dei metaboliti da questo prodotti influenzino le malattie autoimmuni.
Sebbene le prove attuali supportino che i cambiamenti nel microbiota intestinale possono influenzare l’equilibrio delle cellule Th17 e delle Treg, che influenzano anche i livelli di citochine pro/antinfiammatorie, resta ancora da lavorare tanto per comprendere appieno i meccanismi dell’interazione tra il microbiota intestinale ed il sistema immunitario.
Fonti
- Falony G., Vlachou A., Verbrugghe K., De Vuyst L. “Cross-Feeding between Bifidobacterium longum BB536 and Acetate-Converting, Butyrate-Producing Colon Bacteria during Growth on Oligofructose” Appl. and Env. Microbiol. 2006, Vol. 72 p. 7835–7841.
- Horta-Baas G., del Socorro Romero-Figueroa M., Montiel-Jarquín A.J., Pizano-Zárate M.L., García-Mena J. and Ramírez-Durán N. “Intestinal Dysbiosis and Rheumatoid Arthritis: A Link between Gut Microbiota and the Pathogenesis of Rheumatoid Arthritis” Journal of Immunology. 2017, Article ID 4835189, 13 pages.
- Ji-Won Kim, Seung-Ki Kwok, Jung-Yoon Choe and Sung-Hwan Park “Recent Advances in Our Understanding of the Link between the Intestinal Microbiota and Systemic Lupus Erythematosus” Int. J. Mol. Sci. 2019, 20, 4871.
- Jorg S., Grohme D.A, Erzler M., Binsfeld M., Aiden H. et al “Environmental factors in autoimmune diseases and their role in multiple sclerosis” Cell. Mol. Life Sci. 2016, 73:4611–4622.