Obbiettivo dello studio del veleno di vespa
Una ricerca pubblicata sulla rivista Proceedings of the National Academy of Sciences da un team della Perelman School of Medicine, University of Pennsylvania annuncia l’elaborazione di un potente antimicrobico sintetizzato dal veleno di vespa. Si parla in particolare della Vespula lewisii, una specie di vespa coreana anche detta yellowjacket. Esperimenti condotti sui topi hanno dimostrato che, una volta iniettato l’antimicrobico, i roditori erano protetti da infezioni da parte di batteri.
Veleno di vespa per nuovi antimicrobici
Secondo le stime del U.S. Centers for Disease Control & Prevention negli States si registrano 3 milioni di ammalati di cui 35.000 morti all’anno per infezione da batteri antibiotico-resistenti. Fino al 2017 le sepsi, condizioni infiammatorie croniche dovute ad infezioni batteriche, hanno fatto mediamente una vittima su cinque.
Il Professor César de la Fuente, data l’urgenza di nuovi trattamenti contro questi batteri, ha condotto una ricerca assieme al suo team per estrarre una tossina dal veleno di vespa. Tramite un processo di bio-ingegneria l’abilità antimicrobica della molecola estratta è stata migliorata.
Sintesi della molecola
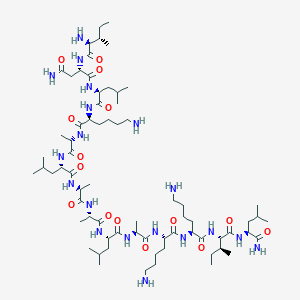
Il team di De la Fuente ha lavorato su di un piccolo peptide, il mastoparan-L (Fig.1 e 2), il quale è ingrediente chiave del veleno della vespa asiatica. Mastoparan-L ha un grande potenziale tossico, può distruggere i globuli rossi umani e scatenare reazioni infiammatorie. A piccole dosi non è mortale per l’uomo, tranne nei soggetti allergici o immunodepressi ai quali provoca anafilassi. Con essa la pressione sanguigna si abbassa drasticamente provocando anche l’arresto respiratorio. Il peptide presenta già in natura una moderata tossicità contro i batteri.
L’obbiettivo del team è stato l’elaborazione di un processo di ingegneria genetica per inserire un nuovo dominio antimicrobico nel mastoparan-L. La mutazione indotta potrebbe aumentare il potenziale del peptide contro i batteri e ridurre la pericolosità per l’uomo.

Sperimentazione
Il team ha utilizzato un database contenente peptidi antimicrobici per stabilire quale fosse il dominio ideale con cui modificare mastoparan-L. Hanno quindi identificato una regione, un motif pentapetide, associata ad una forte attività antibatterica. Il gruppo ha quindi utilizzato questo motif per sostituire il dominio che nel naturale mastoparan-L aggredisce i globuli rossi nell’uomo.
Il team ha quindi somministrato la nuova molecola ad un set di cavie, topi maschio e femmina di diverse età, dopo che queste erano state infettate da batteri potenzialmente mortali per il roditore, ovvero E. coli ed S. aureus causanti sepsi. Hanno poi ripetuto l’esperimento somministrando però ai topi l’originale mastoparan-L. I risultati sono stati incoraggianti, in quanto la nuova molecola, denominata mast-MO, ha portato alla sopravvivenza dell’80% dei topi infetti, mentre la somministrazione del peptide originale ha indotto ad un minor tasso di sopravvivenza dei roditori presentando inoltre, in alcuni esemplari, effetti collaterali come infiammazioni.
Conclusioni
La molecola mast-MO presenta un grande potenziale antimicrobico. Il suo livello di efficacia è comparabile a farmaci già esistenti come gentamicina ed imipenem, per i quali però alcuni ceppi batterici hanno già sviluppato antibiotico resistenza. Il peptide mast-MO aggredisce la membrana batterica, rendendola più porosa, e in questo si può combinare con altri antibiotici in quanto ne faciliterebbe l’inserimento nella cellula.
Oltre a questo mast-MO sembra attivare ed attirare i globuli bianchi, indi per cui il roditore elimina la minaccia microbica in maniera naturale e senza che si scatenino fenomeni immunitari dannosi come infiammazioni e shock anafilattici. Il team sta attualmente sintetizzando diverse varianti della mast-MO e, ad oggi, diverse di queste presentano un’efficacia considerevole contro le infezioni batteriche.
Bibliografia
- Osmar N. Silva, Marcelo D. T. Torres, Jicong Cao, Elaine S. F. Alves, Leticia V. Rodrigues, Jarbas M. Resende, Luciano M. Lião, William F. Porto, Isabel C. M. Fensterseifer, Timothy K. Lu, Octavio L. Franco, Cesar de la Fuente-Nunez. Repurposing a peptide toxin from wasp venom into antiinfectives with dual antimicrobial and immunomodulatory properties. Proceedings of the National Academy of Sciences, 2020; 202012379 DOI: 10.1073/pnas.2012379117
- Repurposing a peptide toxin from wasp venom into antiinfectives with dual antimicrobial and immunomodulatory properties.Osmar N. Silva, Marcelo D. T. Torres, Jicong Cao, Elaine S. F. Alves, Leticia V. Rodrigues, Jarbas M. Resende, Luciano M. Lião, William F. Porto, Isabel C. M. Fensterseifer, Timothy K. Lu, Octavio L. Franco, Cesar de la Fuente-Nunez. PNAS first published October 12, 2020; https://doi.org/10.1073/pnas.2012379117