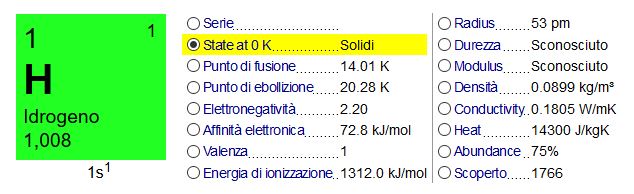
| Informazione | Valore |
|---|---|
| Numero atomico | 1 |
| Massa atomica | 1.007825 g.mol^-1 |
| Elettronegatività (Pauling) | 2.1 |
| Densità | 0.0899*10^-3 g.cm^-3 at 20°C |
| Punto di fusione | -259.2°C |
| Punto di ebollizione | -252.8°C |
| Raggio di Van der Waals | 0.12 nm |
| Raggio ionico | 0.208 (-1) nm |
| Isotopi | 3 |
| Guscio elettronico | 1s1 |
| Energia di prima ionizzazione | 1311 kJ.mol^-1 |
| Scoperto da | Henry Cavendish nel 1766* |
L’idrogeno fu osservato e raccolto molto prima che fu riconosciuto come gas unico da Robert Boyle nel 1671, che dissolse il ferro in acido idrocloridrico diluito.
Caratteristiche generali dell’Idrogeno
L’Idrogeno è il primo elemento presente nella tavola periodica. In condizioni normali, si presenta come un gas insapore e incolore costituito da molecole diatomiche, H2. L’atomo di idrogeno, simboleggiato con la lettera H, è composto da un nucleo con una singola carica positiva e un elettrone. Il suo numero atomico è 1 e il suo peso atomico è pari a 1,00797 g/mol. Questo elemento è uno dei principali costituenti dell’acqua e di tutti i composti organici. Inoltre, è ampiamente diffuso non solo sulla Terra, ma anche nell’intero universo.
Esistono tre isotopi dell’idrogeno: il protio, con una massa pari a 1, costituisce più del 99,985% dell’elemento naturale; il deuterio, con una massa pari a 2, si trova in natura in circa lo 0,015%; il trizio, con una massa pari a 3, è presente in quantità molto limitate in natura, ma può essere prodotto artificialmente attraverso varie reazioni nucleari.
Utilizzo dell’Idrogeno
L’idrogeno è un elemento chimico che trova il suo uso più importante nella sintesi dell’ammoniaca. Tuttavia, la sua utilità si sta estendendo rapidamente anche in altri settori, come ad esempio nella raffinazione dei combustibili, nella scissione dell’idrogeno (idrocracking) e nell’eliminazione dello zolfo. Grandi quantità di idrogeno vengono impiegate nell’idrogenazione catalitica degli oli vegetali insaturi per ottenere grassi solidi, nonché nella produzione di prodotti chimici organici. Inoltre, l’idrogeno viene utilizzato come combustibile per i razzi insieme ad ossigeno o fluoro, nonché come propellente per i razzi azionati dall’energia nucleare.
Un’altra possibile utilità dconsiste nella sua combustione nei motori a combustione interna. In questo ambito, le celle di carburante ad idrogeno rappresentano una possibile soluzione per la produzione di energia, e molte ricerche sull’idrogeno come fonte alternativa di carburante sono in corso. Ad esempio, l’idrogeno può essere convertito in elettricità da biocarburanti, gas naturale e carburante diesel, in teoria senza alcuna emissione di CO2 o agenti chimici tossici.
Proprietà
L’idrogeno è uno degli elementi chimici più interessanti e complessi che conosciamo. Con un peso molecolare di 2,01594 g, è un gas con una densità di 0,071 g/l a 0ºC e 1 atmosfera. La sua densità relativa è pari a 0,0695 rispetto all’aria. Tuttavia, nonostante la sua bassa densità, l’idrogeno è uno dei gas più infiammabili al mondo.
L’idrogeno è leggermente più solubile in solventi organici rispetto all’acqua e può essere facilmente assorbito da molti metalli. Tuttavia, l’assorbimento di idrogeno da parte dell’acciaio può portare ad acciaio fragile e causare problemi nei processi chimici. A temperatura normale, l’idrogeno è una sostanza poco reattiva, a meno che non sia attivato da un catalizzatore adeguato. Tuttavia, ad alte temperature, diventa altamente reattivo.
Gli effetti dell’idrogeno sulla salute umana
L’idrogeno molecolare, nonostante sia diatomico in generale, può dissociarsi in atomi liberi a temperature elevate. L’idrogeno atomico è un forte agente riducente, anche a temperatura ambiente. Questo elemento chimico reagisce con ossidi e cloruri di numerosi metalli, come argento, rame, piombo, bismuto e mercurio, per produrre metalli liberi. Inoltre, riduce alcuni sali alla loro forma metallica, come i nitrati, i nitriti e il cianuro di sodio e potassio. L’idrogeno atomico è in grado di reagire con vari elementi, sia metalli che non metalli, per formare idruri, come ad esempio il NAH, il KH, l’H2S e il PH3. La reazione tra idrogeno atomico e ossigeno produce il perossido di idrogeno H2O2.
In presenza di composti organici, l’idrogeno reagisce per formare una miscela complessa di prodotti; ad esempio, con l’etilene (C2H4), si ottiene etano (C2H6) e butano (C4H10). Il calore rilasciato quando gli atomi di idrogeno si combinano per formare le molecole di idrogeno viene sfruttato per raggiungere elevate temperature durante la saldatura con idrogeno atomico.
La reazione tra idrogeno e ossigeno forma acqua, ma a temperatura ambiente questa reazione avviene molto lentamente; se accelerata da un catalizzatore come il platino o da una scintilla elettrica, invece, avviene con violenza esplosiva.
Esposizione
L’esposizione all’idrogeno può avere effetti pericolosi sulla salute umana e sulla sicurezza. La sostanza è altamente infiammabile e molte reazioni possono causare incendio o esplosione. Le miscele gas/aria possono essere esplosive. L’idrogeno può essere assorbito nel corpo attraverso l’inalazione. Le alte concentrazioni di questo gas possono causare un ambiente carente di ossigeno, il che può provocare emicranie, fischi nelle orecchie, stordimento, incoscienza, nausea, vomito e inibizione di tutti i sensi. In alcuni casi estremi, l’esposizione all’idrogeno può causare la morte e la pelle della vittima può avere un colore blu. Non si ritiene che l’idrogeno sia mutageno, embriotossico, teratogeno o tossico per la riproduzione, ma le disfunzioni respiratorie preesistenti possono essere aggravate dalla sovresposizione ad idrogeno. È importante adottare precauzioni adeguate per gestire l’idrogeno in modo sicuro e prevenire gli effetti dannosi sulla salute e sulla sicurezza.
Inalazione
Il gas in questione rappresenta una minaccia per la salute in quanto può essere assorbito dall’organismo attraverso l’inalazione. In particolare, la perdita di contenimento può provocare un’elevata concentrazione di gas nell’aria, con il rischio di causare sintomi quali mal di testa, vertigini, nausea, vomito e mancanza di respiro. È importante prestare particolare attenzione ai sintomi di sovraesposizione, in quanto questi possono essere molto pericolosi per la salute e, in alcuni casi, possono portare alla morte. Inoltre, il gas in questione può essere altamente infiammabile, rappresentando una minaccia per l’incolumità delle persone e dei beni. Pertanto, è essenziale adottare tutte le misure necessarie per evitare perdite di contenimento e garantire la massima sicurezza.
Pericoli fisici e chimici
Il gas è altamente miscibile con l’aria, e può facilmente formare miscele esplosive. Inoltre, è più leggero dell’aria e tende a diffondersi rapidamente. Il riscaldamento del gas può causare combustione o esplosioni violente. In presenza di aria, ossigeno, alogeni o ossidanti forti, il gas può reagire in modo violento, aumentando notevolmente il rischio di incendio ed esplosione. L’uso di catalizzatori metallici, come il platino e il nichel, può amplificare ulteriormente queste reazioni chimiche.
L’elevata concentrazione di questo gas nell’aria può causare una riduzione di ossigeno con il rischio di perdita di coscienza e morte. Pertanto, in caso di pericolo, è importante controllare il livello di ossigeno prima di entrare in una determinata area. Inoltre, le concentrazioni tossiche di questo gas non sono rilevabili dal nostro olfatto, pertanto è consigliabile utilizzare un’apposita rilevazione per misurarne la concentrazione. Si raccomanda l’uso di un rilevatore specifico per l’idrogeno, poiché un rilevatore di gas infiammabile standard non è adeguato per questo scopo.
Primo soccorso
In caso di emergenza, è importante sapere come agire per prestare i primi soccorsi in sicurezza. Nel caso di incendio, è necessario spegnere la fonte del fuoco, lasciando che si estingua da solo se non rappresenta alcun pericolo per l’area circostante. In caso contrario, si può utilizzare acqua, polvere o anidride carbonica per spegnere le fiamme. Nel caso di un’esplosione, è importante mantenere il cilindro freddo spruzzando acqua e cercare di combattere l’incendio da una posizione riparata. Nel caso di inalazione di gas tossici, è necessario respirare aria fresca e riposare, potrebbe essere necessaria la respirazione artificiale e si dovrebbe consultare immediatamente un medico. In caso di lesioni cutanee, è sempre meglio consultare un medico. È importante conoscere le procedure di primo soccorso in modo da poter agire rapidamente ed efficacemente in caso di emergenza.
Gli effetti dell’Idrogeno sull’ambiente
L’idrogeno nell’ambiente è uno dei componenti più diffusi della Terra, costituendo circa lo 0,15% della crosta terrestre e il 14% in peso della biomassa. Inoltre, il gas idrogeno è presente in atmosfera in diverse proporzioni, come il vapore acqueo e 0,5 ppm di idrogeno molecolare H2.
L’idrogeno è caratterizzato da una grande stabilità ambientale e si disperde rapidamente in zone ben ventilate. Per quanto riguarda l’effetto sulla vita animale, non sono stati riscontrati effetti negativi sulle piante, a meno che non sia presente un gas ad espansione rapida che può causare il congelamento.
Per quanto riguarda l’effetto sulla vita acquatica, attualmente non esistono prove dell’effetto dell’idrogeno sulla vita marina. Tuttavia, in ambienti carenti di ossigeno, l’idrogeno può causare problemi per gli animali. Pertanto, è importante monitorare le concentrazioni di gas nell’ambiente per evitare eventuali problemi.
Fonti
- https://www.lenntech.it/periodica/elementi/h.htm
- siad.com
- https://www.microbiologiaitalia.it/batteriologia/dark-fermentation-e-bioidrogeno/