L’uomo nei secoli ha sviluppato sempre più la sua insaziabile curiosità e desiderio di apprendere il mondo ed il funzionamento del proprio corpo. In questa ricerca della conoscenza si è trovato però difronte ad un limite oggettivo, l’impossibilità di vedere il microscopico. Grazie all’avvento di strumenti di microscopia sempre più sofisticati e all’applicazione di tecniche come l’immunofluorescenza, l’uomo è stato capace di superare questo limite ed ampliare le sue possibilità di conoscenza. In questo articolo vedremo un protocollo standard di immunofluorescenza e la spiegazione dei vari passaggi.
Obiettivo della tecnica
L’immunofluorescenza, come dice il nome stesso, è un tecnica di immunologia accoppiata al fenomeno della fluorescenza. Di base questa tecnica permette di osservare ed individuare proteine specifiche in tessuti, cellule, sieri unendo l’utilizzo di anticorpi specifici e l’emissione di un segnale luminoso. Come vedremo nel corso dell’articolo, il rilevamento di un segnale luminoso avviene solo se l’anticorpo usato ha riconosciuto la proteina/antigene bersaglio.
Materiale occorrente
Di seguito sono elencati i reagenti/materiali richiesti per applicare un protocollo di immunofluorescenza indiretta.
- Campione biologico da analizzare su vetrino: sezioni di tessuto o cellule coltivate in vetrino
- Phosphate-buffer saline o PBS: soluzione isotonica usata per lavare e come base per gli altre soluzioni
- Albumina (BSA) o siero di animale (capra, asino, cavallo…)
- Anticorpo(i) primario(i): necessari per osservare la(e) proteina(e) di interesse
- Anticorpo(i) secondario(i) coniugato(i) con fluoroforo(i) desiderati
- Colorante nucleare fluorescente
- Gliocerolo 80% o montante commerciale
In aggiunta, se l’osservazione è diretta contro proteine nucleari o citoplasmatiche meglio munirsi anche di un detergente come il TritonX o il Tween20. Per maggiori dettagli vai all’ultimo paragrafo.
Protocollo di immunofluorescenza
I passaggi per ottenere dei buoni risultati in immunofluorescenza non sono molti e, seppur abbastanza standardizzato, il protocollo può subire delle modifiche sulla base dell’esperienza dell’operatore e delle esigenze. In ogni caso gli step da seguire sono i seguenti e verranno singolarmente spiegati nelle sezioni successive. Prima di iniziare il protocollo si considera che il campione sia già stato fissato e preparato secondo le esigenze.
- Effettuare 3 lavaggi del campione con PBS per 5′
- Bloccare i siti aspecifici delle sezioni di tessuto/cellule con BSA 5% in PBS o siero di animale al 10% in PBS. Incubare per 60′ a temperatura ambiente.
- Incubare le sezioni di tessuto/cellule con l’anticorpo(i) desiderato(i) diluito in BSA 2.5% o siero animale al 5% per 1 ora a 37°C o over-night a 4°C.
- Effettuare 3 lavaggi del campione con PBS per 5′
- Incubare con l’anticorpo(i) secondario(i) diluito in n BSA 2.5% o siero animale al 5% per 1 ora a temperatura ambiente
- Effettuare 3 lavaggi del campione con PBS per 5′
- Incubare le sezioni di tessuto/cellule con colorante nucleare fluorescente (tempo e quantità dipendono da colorante)
- Effettuare 3 lavaggi del campione con PBS per 5′
- Montare il vetrino con un vetrino coprioggetto usando gliocerolo 80% o un reagente commerciale come montante.
- Osservazione al microscopio a fluorescenza
Se il colorante nucleare è compatibile, il punto 7 può essere eseguito insieme al punto 5, escludendo di conseguenza i lavaggi al punto 8.
Spiegazione passo passo del protocollo di immunofluorescenza
Passiamo ora a spiegare brevemente il perchè dei vari passaggi del protocollo di immunofluorescenza. Conoscere il perchè si applica un protocollo aiuta sicuramente ad affrontare i problemi e a migliorare i risultati.
I lavaggi
Partiamo dal concetto più semplice: i lavaggi con PBS al punto 1-4-6-8. Il primo lavaggio può avere diversi scopi a seconda di come otteniamo il campione. Difatti se il campione è una sezione di tessuto che è stata precedentemente disidratata, è necessario procedere ad una reidratazione in PBS. Oppure, se il campione è fresco ed è stato appena fissato in PFA (per esempio), è necessario togliere il fissativo in eccesso ed essere sicuri di avere un campione pulito. I lavaggi degli altri punti del protocollo servono per togliere l’eccesso di anticorpo primario/secondario usato per l’immunofluorescenza e di colorante nucleare che, al termine dell’incubazione, non si sono legati al campione. Togliere l’eccesso è indispensabile per evitare segnali aspecifici e rumore di fondo nell’immunofluorescenza.
La saturazione dei siti aspecifici e l’incubazione con l’anticorpo primario
I punti 2 e 3 sono forse i più delicati nel protocollo di immunofluorescenza e possono fare la differenza tra un buon risultato o un fiasco.
Il concetto che sta alla base è rendere il legame anticorpo-antigene il più specifico e pulito possibile. Il blocco o saturazione (punto 2) è la fase del protocollo in cui si coprono con albumina o proteine del siero tutti gli antigeni specifici ed aspecifici a cui potrebbe legarsi l’anticorpo primario. In seguito, l’anticorpo primario aggiunto al punto 3, sarà in grado di scalzare le proteine del blocco e legarsi solo il prossimità dell’antigene specifico per il quale ha un’alta affinità di legame. Per migliorare ulteriormente la specificità di legame, l’anticorpo è mantenuto in una soluzione con metà (generalmente) delle proteine usate per la saturazione.
Una domanda potrebbe sorgere spontanea: quanto anticorpo primario bisogna usare nel protocollo per avere una bella immunofluorescenza? In gergo si parla di diluizione dell’anticorpo e diciamo subito che la risposta è solo una: dipende. Dipende dall’abbondanza della proteina che si vuole osservare, da quanto è concentrata la provetta madre dell’anticorpo e naturalmente dipende dalla ditta che lo produce/vende. In questo campo, come in altri della ricerca, vale (abbastanza) la regola “più costa meglio funziona” e le prove sono sempre necessarie per avere un risultato ottimale.
Come scegliere l’anticorpo giusto? Un consiglio che mi sento di dare è di scegliere anticorpi già usati in altri lavori o di farsi mandare delle aliquote di prova, se possibile, una volta individuato il target. Se poi è possibile provare un anticorpo prestato da un laboratorio vicino tanto meglio. Naturalmente è molto importante anche tener conto dell’animale da cui derivano gli anticorpi prodotti (topo, coniglio, ratto,…) perchè questo determina la scelta dell’anticorpo secondario da usare e la possibilità di osservare più target contemporaneamente.
Incubazione con anticorpo secondario e colorazione nucleare
Gli anticorpi secondari sono così chiamati solo perchè si usano dopo gli anticorpi primari ma, per fare un gioco di parole, assumono anch’essi un ruolo primario nel protocollo. Gli anticorpi secondari per immunofluorescenza riconoscono gli anticorpi primari in modo specie specifico e sono coniugati (legati) con molecole fluorescenti (fluorofori) che sono in grado di emettere luce in una porzione precisa dello spettro luminoso (vedi Fig.1).
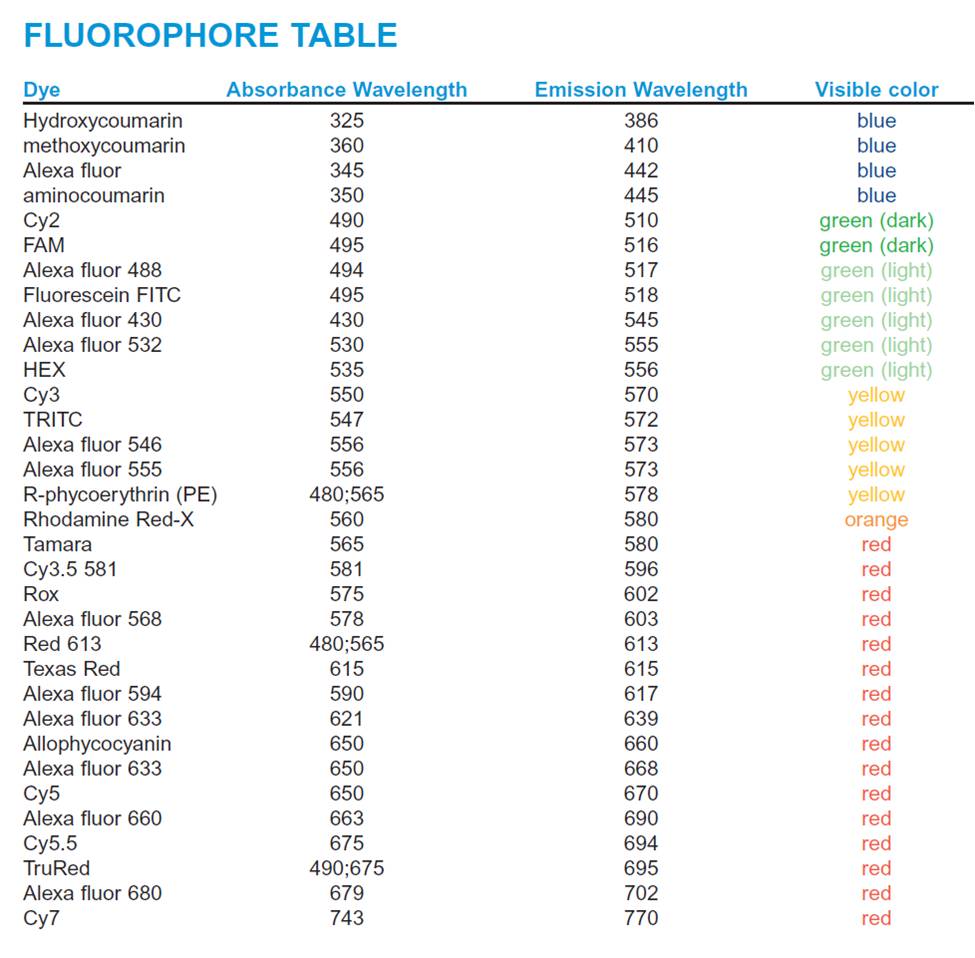
Sulla base dell’animale da cui deriva l’anticorpo primario verrà utilizzato un anticorpo secondario specifico. Se il primario usato è stato prodotto in topo, allora bisognerà usare un anticorpo secondario anti-topo; se il primario è di ratto verrà usato un secondario anti-ratto e così via. Questo significa che (al punto 5) si possono usare contemporaneamente più anticorpi primari, diretti contro antigeni diversi, purchè siano di specie differenti; usando secondari specie specifici coniugati con fluorofori differenti si potrà osservare contemporaneamente il segnale di tutti gli antigeni target. L’unica cosa da controllare è che i fluorofori usati emettano un segnale in porzioni distanti nello spettro luminoso (per controllare le emissioni dei vari fluorofori vedi qui).
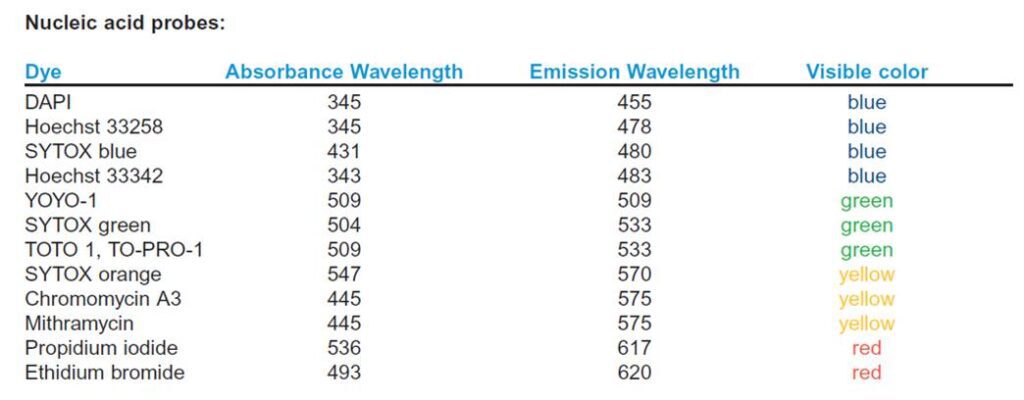
Infine, è spesso utile individuare anche il nucleo delle cellule del campione osservato per poter capire meglio la distribuzione del segnale target o la composizione del tessuto. Si possono usare diversi coloranti nucleari fluorescenti (vedi figura sotto) che naturalmente devono avere uno spettro di emissione compatibile con i fluorofori usati con gli anticorpi secondari.
Passaggi opzionali, ma spesso utili, del protocollo di immunofluorescenza
Osservazioni di proteine citoplasmatiche e/o nucleari. Se la proteina/antigene target non è nella membrana plasmatica o nella matrice extracellulare è necessario applicare un passaggi di permeabilizzazione. In pratica bisogna creare dei buchi nella membrana plasmatica e nucleare con un detergente per permettere agli anticorpi primari e secondari di entrare nella cellula. Prima della saturazione (punto 2) si applica una incubazione con TritonX 0,1% o altri detergenti per 10′ a temperatura ambiente per poi continuare normalmente il protocollo.
Smascheramento dell’antigene. Può capitare che il processo di fissazione e di preparazione del campione abbia causato un mascheramento dell’antigene target rendendo impossibile il riconoscimento da parte dell’anticorpo primario. Il processo di smascheramento può essere eseguito come primo passaggio del protocollo e si può utilizzare un approccio di tipo enzimatico oppure termico.
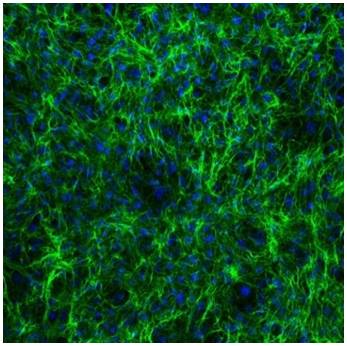
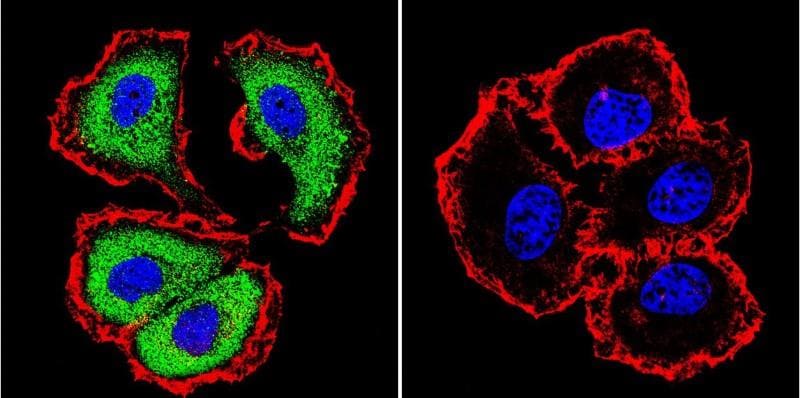
Immagini microscopiche
Fonti
- https://ibidi.com/content/365-immunofluorescence-staining-a-typical-workflow
- https://www.sinobiological.com/category/if-protocol
- https://www.abcam.com/protocols/immunocytochemistry-immunofluorescence-protocol
- https://www.peprotech.com/en/protocols-antigen-retrieval
Crediti immagini
- Immagini di copertina: https://www.cell.com/pictureshow/immunofluorescence
- Fig1 e 2: https://www.abcam.com/ps/pdf/protocols/Fluorophore%20table.pdf
- Fig3: Da Ros et al. Emilin-2 is a component of bone marrow extracellular matrix regulating mesenchymal stem cell differentiation and hematopoietic progenitors. Stem Cell Res Ther. 2022 doi: 10.1186/s13287-021-02674-2.
- Fig4: https://www.novusbio.com/antibody-news/antibodies/applications-focus-labeling-with-multiple-secondary-antibodies