Introduzione
Le parassitosi intestinali costituiscono un importante problema di salute pubblica, in particolare nei paesi in via di sviluppo, dove il basso livello socio-economico, la scarsa igiene e il clima ne favoriscono la diffusione. La maggior parte dei parassiti è ubiquitaria, sebbene la massima diffusione si abbia nei paesi tropicali e subtropicali.
L’Italia è stata, fino a pochi decenni fa, area endemica per diversi parassiti e tra questi troviamo Giardia Lamblia nota anche come Giardia intestinalis o duodenalis. Giardia è un protozoo flagellato, cosmopolita, ha come ospiti sia l’uomo sia 40 diverse specie animali e causa appunto la Giardiasi, una zoonosi che si trasmette per via oro-fecale: una volta entrata nell’organismo, la giardia provoca diarrea e disidratazione; precedentemente inclusa nell’iniziativa dell’OMS sulle malattie trascurate ed fu direttamente associata alla povertà e alla scarsa qualità delll’acqua potabile.
Questi microrganismi flagellati si attaccano in modo deciso alla mucosa del duodeno e del tratto superiore dell’intestino tenue, dove si moltiplicano per scissione binaria e danno origine ad un processo infiammatorio. L’infezione acuta si sviluppa per un periodo di tre settimane, raggiungendo un picco a otto giorni dall’infezione. Generalmente, gli ospiti sani eliminano l’infezione entro 2-3 settimane, mentre l’ospite occasionalmente infetto cronicamente mostra segni di atrofia dei villi e dei cripti, apoptosi enterocitaria e, in definitiva, grave interruzione della funzione di barriera epiteliale. Infezione da G . lamblia è stata anche collegata allo sviluppo della sindrome dell’intestino irritabile e dell’affaticamento cronico.
Sopravvivenza di Giardia intestinalis nell’ambiente
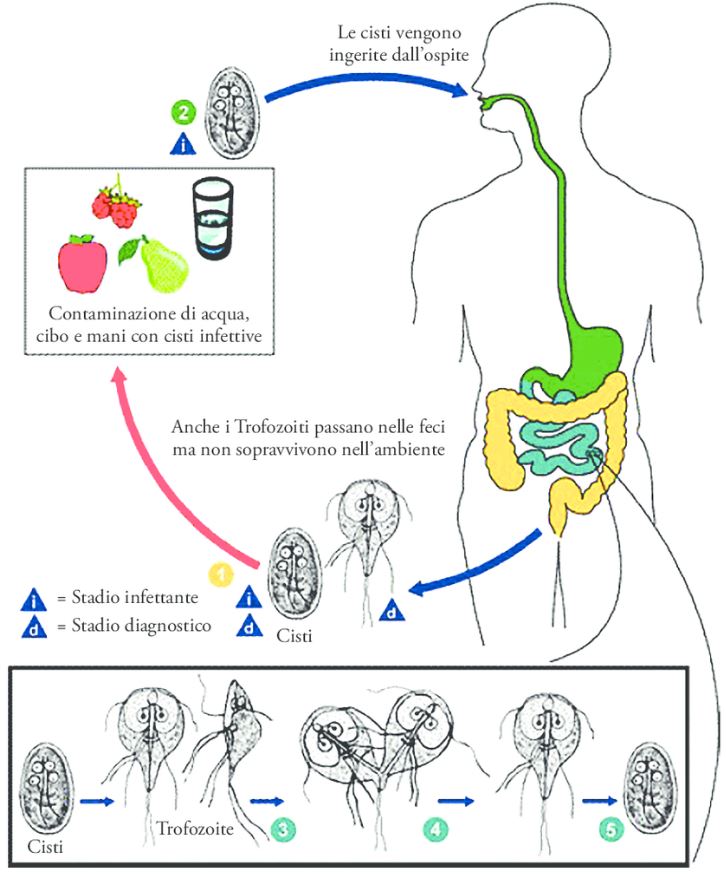
Dal ciclo di vita alla trasmissione di un nuovo ospite, Giardia intestinalis non richiede vettori e si basa sull’alternanza di uno stadio vegetativo, il trofozoite e uno stadio infettivo resistente all’ambiente: la cisti.
La cisti è in grado di sopravvivere al di fuori dell’ospite ed è responsabile dell’inizio di un nuovo ciclo infettivo. Lo sviluppo della cisti può già iniziare nell’intestino tenue degli ospiti parassiti quando una frazione variabile di trofozoiti proliferanti avvia un programma di differenziazione cellulare chiamato incistamento. I protocolli di laboratorio per indurre l’incistazione comprendono l’esaurimento dei lipidi e un aumento del pH del mezzo di coltura per un periodo di circa 20-24 ore. Il presupposto è che queste condizioni imitino la riduzione della disponibilità lipidica e la gradazione crescente del pH, naturalmente presente lungo il tratto gastrointestinale.
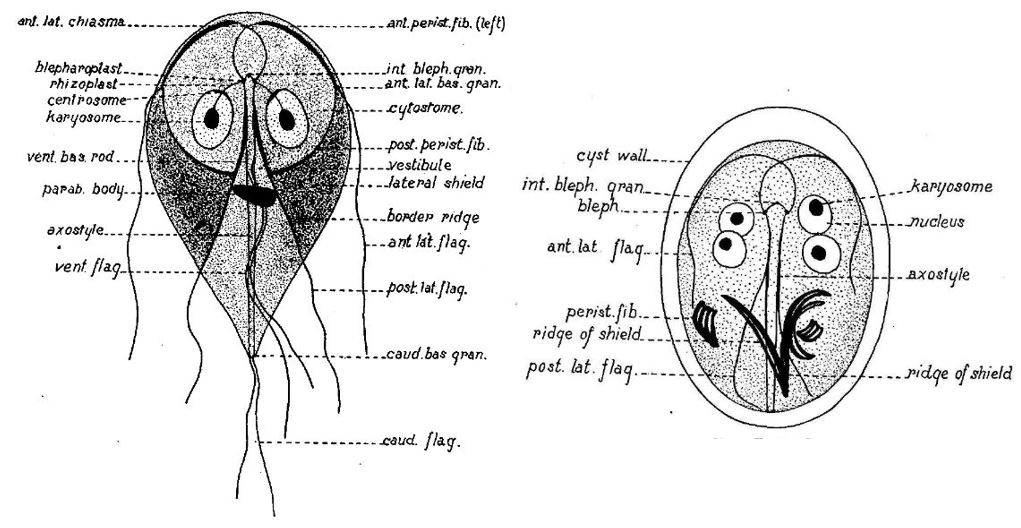
Durante l’incistazione, i trofozoiti binucleati a forma di pera flagellati subiscono un drammatico rimodellamento cellulare morfologico e biochimico, che culmina nella formazione di cisti quadrinucleate ovali non flagellate, circondate da una parete di cisti (CW). Il CW è composto da una fitta rete di proteine della parete della cisti (CWP) complessate in un polimero di zucchero unico di β1,3-N-acetilgalattosamina andando a protegge l’interno della cisti da qualsiasi solvente. La deposizione del CW è un evento strettamente regolato che si verifica esclusivamente nell’incistamento dei trofozoiti e richiede la neogenesi di organelli di secrezione specializzati chiamati ESV.
Gli ESV trafficano, ordinano e modificano principalmente CWP dal loro sito iniziale di deposizione lungo il tragitto verso la superficie della cellula parassita. È stato dimostrato che l’eliminazione di un singolo CWP, darà una completa distruzione genica abolendo del tutto la formazione di CW. Questi risultati sostengono che il pH naturale e i gradienti lipidici siano gli unici fattori scatenanti esterni per la differenziazione. A sua volta, ciò solleva l’interessante possibilità che i trofozoiti possano alterare sufficientemente l’ambiente locale per generare condizioni favorevoli all’attivazione della differenziazione. Le cisti vengono quindi rilasciate attraverso le feci ospiti e si dice che rimangano vitali per diversi mesi in acqua a temperature inferiori a 10 °C e diverse settimane a temperatura ambiente. Sulla base di infezioni sperimentali di gerbillo (Meriones ungulatus), la dose minima infettiva è inferiore a 10 cisti.
Trasmissione alimentare di Giardia intestinalis
La trasmissione di Giardia all’uomo può avvenire attraverso il contatto diretto con esseri umani e animali infetti, nonché attraverso il consumo di acqua e/o cibo contaminato da cisti. Un fattore che facilita la trasmissione della giardiasi è la bassa dose infettiva, con persino l’ingestione di una singola cisti con una probabilità del 2% di causare la giardiasi. Le loro piccole dimensioni (8-12 μmdi lunghezza), consentono di poter penetrare e sopravvivere a filtri per l’acqua come i filtri a sabbia, che sono comunemente utilizzati dall’industria dell’acqua e la capacità di Giardia di sopravvivere a basse temperature, indicano che le cisti sulla superficie di insalate o erbe possono essere ancora vitali anche dopo alcuni giorni in un frigorifero domestico. La temperatura e l’umidità influenzano criticamente la sopravvivenza e la trasmissione delle cisti di Giardia sulle matrici alimentari.
Un recente studio ha riferito che sia le cisti di Giardia che quelle di Cryptosporidium sopravvivono bene in condizioni di umidità e refrigerazione; quando la lattuga è stata conservata a temperatura ambiente, il circa 50% delle cisti ha perso vitalità entro le prime 24 ore. Se trasportate in condizioni adeguatamente fresche e umide, tuttavia, le cisti di Giardia possono sopravvivere per lunghi periodi. I cambiamenti climatici possono anche aumentare la trasmissione di cisti di Giardia in tutto il mondo.
Ad esempio, un aumento del numero e della forza di eventi di precipitazione estremi aumenterà probabilmente il deflusso superficiale di campioni fecali animali contenenti cisti di Giardia in corsi d’acqua utilizzati per l’irrigazione di frutta e verdura fresca. Temperature ambientali più elevate possono anche far sopravvivere cisti di Giardia in corpi idrici precedentemente congelati in inverno ma, al contrario, temperature più elevate possono anche ridurre la vitalità di Giardia sui prodotti.
Meccanismi epigenetici in Giardia intestinalis
Lo studio di Giardia è rilevante e sebbene questo organismo microaerofilo mostri molte caratteristiche procariotiche nei processi metabolici, diversi rapporti hanno suggerito che questi organismi siano il risultato di un’evoluzione riduttiva piuttosto che una conseguenza della ramificazione precoce. Sorprendentemente, Giardia è caratterizzato da un genoma molto compatto con una significativa semplificazione della maggior parte dei processi cellulari, anche privo di alcuni organelli tipici delle cellule eucariotiche superiori, come un apparato del Golgi classico, perossisomi e mitocondri respiratori. Pertanto, in molti percorsi in cui sono richiesti complessi multiproteici, è notevole che Giardia abbia meno componenti riconoscibili rispetto ad altri organismi.
A questo proposito, il parassita è un modello conveniente da sfruttare per studiare i processi biologici di base degli eucarioti superiori (vertebrati, mammiferi e altri correlati), contribuendo così, con preziosi indizi, a delimitare i componenti minimi necessari in questi processi biologici. Giardia Lamblia possiede dei siti per modifiche post-traduzionli, conservati evolutivamente. In generale, le modifiche post-traduzionali delle proteine consentono alle cellule di rispondere rapidamente e specificamente agli stimoli endogeni o esogeni al fine di evitare la sintesi di proteine de novo, un processo che richiede tempo e consuma energia.
In particolare, le modifiche post-traduzionali negli istoni sono principalmente legate alla regolazione dell’espressione genica e quindi hanno ruoli importanti nei processi chiave. Queste modificazioni dell’istone consentono alle cellule di modificare rapidamente l’espressione genica in risposta a stimoli ambientali. L’analisi del genoma di Giardia ha identificato la presenza di enzimi putativi che potrebbero modificare gli istoni, come acetiltranferasi, metiltransferasi, specifiche protein chinasi, ubiquitina protein ligasi.
Ciò suggerisce che esistono meccanismi epigenetici che regolano l’espressione genica in questo parassita, aprendo un’area promettente di ricerca, sebbene allo stesso tempo la metilazione del DNA non sia stata dimostrata in questo organismo. Le alterazioni nell’espressione genica dei patogeni eucariotici possono essere dannose per la virulenza e il ciclo di vita.
Sarà quindi importante descrivere i diversi meccanismi epigenetici coinvolti in Giardia e come questi svolgono ruoli rilevanti nella sua patogenicità, specialmente durante la differenziazione dei parassiti, la variazione antigenica e la resistenza antimicrobica, aree che potrebbero essere successivamente utilizzate per ottimizzare i trattamenti per la giardiasi e altre infezioni da protozoi.
Incistamento
L’incistamento è fondamentale sia per la trasmissione della malattia sia per la sopravvivenza del parassita. Prima di abbandonare l’intestino ospite, il trofozoite sviluppa una parete di glicoproteina resistente (composta da 60% di carboidrati e 40% di proteine) da trasformare in una cisti. La Giardia possiede meno fattori tipici di trascrizione eucariotica rispetto ad altre cellule eucariotiche.
Pertanto, durante l’incistazione, il fattore di trascrizione autoinducente, simile alla proteina MYB1, coordina l’espressione differenziale dei geni chiave indotti dall’encistazione come la glucosamina6-fosfato (GlcN6P) deaminasi, che è coinvolta nella biosintesi del polisaccaride della parete della cisti e nella codifica dei geni per le proteine che costituiscono la parete protettiva della cisti (CWP 1–3).
È importante chiarire che l’espressione dei CWP è completamente silenziata nella fase del trofozoite ed è completamente attivata durante l’incistamento, mentre la proteina simile a MYB1 e la deiminasi GlcN6P sono semplicemente modulate. Al fine di aumentare la risoluzione del processo di incistamento; alcuni studiosi hanno scoperto che le proteine regolatrici della cromatina come le istone deacetilasi (HDAC), l’istonemetiltransferasi (HMT), l’istone acetiltransferasi (HAT) e il rimodellamento della cromatina-elicasi SNF2 ha mostrato cambiamenti coordinati nell’espressione, suggerendo che il processo di incistamento è regolato, almeno in parte, in modo epigenetico.
La metilazione è un altro meccanismo chiave della regolazione epigenetica. Il Giardia istone metiltransferasi 1 (HMT1) omologo ha mostrato un significativo aumento dell’espressione all’inizio del processo di incistamento. Inoltre, la sovra-espressione di questo enzima ha aumentato il numero di cisti prodotto durante l’induzione. Al contrario, la downregulation di questo enzima usando un costrutto antisenso episomiale ha ridotto significativamente la produzione di cisti. Oltre all’acetilazione e alle variazioni basate sulla metilazione, si è visto come, in Giardia, l’argininadeiminasi (ADI) sia coinvolta nella sopravvivenza dei parassiti e, a parte il suo ruolo noto di enzima metabolico, funziona anche come peptidilarginina deiminasi (PAD), trasformando l’arginina legata alle proteine, in citrullina.
L’ubiquitinazione è un importante processo eucariotico che determina il destino di diverse proteine e la loro funzione. In particolare, è stata segnalata l’ubiquitinazione dei quattro istoni di Giardia: l’ubiquitinazione di H2A appare specifica per i trofozoiti, mentre tutte e quattro le classi d’istoni sono modificate in cisti. È interessante notare che la sovra-espressione dell’enzima E1 che attiva l’ubiquitina aumenta il tasso di incistamento, suggerendo una relazione diretta tra l’ubiquitinazione e la differenziazione di Giardia.
Variazione antigenica
La variazione antigenica è un meccanismo attraverso il quale un agente infettivo altera le sue proteine di superficie al fine di eludere la risposta immunitaria dell’ospite, consentendo l’instaurazione e il mantenimento d’infezioni croniche e/o ricorrenti.
Giardia subisce una variazione antigenica superficiale per cui solo una delle circa 150 proteine superficiali specifiche della variante (VSP) è espressa e localizzata sulla superficie del parassita. Non è chiaro come si verifichino le variazioni antigeniche e i meccanismi coinvolti in Giardia, il processo è abbastanza diverso rispetto ad altri organismi che subiscono anche variazioni antigeniche. In Giardia, il principale meccanismo di controllo della variazione antigenica sembra essere a livello posttrascrizionale per interferenza dell’RNA.
Resistenza al metronidazolo
Si stima che le infezioni sostenute da Giardia tendano ad autorisolversi in 4-6 settimane, anche senza cure. Tuttavia, se alcuni parassiti si nascondono nelle pareti intestinali, i disturbi caratteristici della giardiasi possono protrarsi per molto tempo; per questo motivo, si consiglia di assumere farmaci specifici, volti a debellare l’agente infestante.
Tra gli agenti chimici ricordiamo il Metronidazolo che utilizza le vie metaboliche anaerobiche presenti in Giardia. Il Metronidazoloviene assorbito rapidamente e completamente dopo la somministrazione orale e penetra nei tessuti e nelle secrezioni del corpo come saliva, latte materno, sperma e secrezioni vaginali. Il farmaco sarà metabolizzato principalmente nel fegato e successivamente escreto attraverso le urine. Ma Giardia Duodenalis può essere resistente al metronidazolo; in particolare gli individui HIV-positivi hanno frequenti recidive di giardiasi e non rispondono alle terapie usuali.
Emery e collaboratori hanno dimostrarono che modificazioni epigenetiche e l’espressione proteica differenziale sono associate ai fenotipi della resistenza al metronidazolo (MtzR) in Giardia. I loro risultati indicano che diverse proteine all’interno delle linee MtzR sono soggette a ubiquitinazione differenziale, fosforilazione, metilazione e acetilazione.
Conclusioni
I meccanismi epigenetici, nella regolazione della differenziazione dello stadio, della variazione antigenica e della resistenza antimicrobica, in Giardia duodenalis, sono importanti da sostenere. Sono ora necessari approcci di genetica chimica per identificare le modifiche dell’istone e la loro correlazione con l’espressione genica, nonché dare priorità alla ricerca di composti che colpiscono il macchinario epigenetico di Giardia. Tali approcci aiuteranno a sviluppare trattamenti per sopprimere efficacemente la produzione di cisti e quindi ridurre la trasmissione della malattia, oltre a superare la resistenza antimicrobica e l’evasione immunitaria attraverso la variazione antigenica.
Bibliografia
Giulia Zecca
- Barash NR, Nosala C, Pham JK, McInally SG, Gourguechon S, et al. (2017). Giardia Colonizes and Encysts in High-Density Foci in the Murine Small Intestine. mSphere 2.
- Morf L, Spycher C, Rehrauer H, Fournier CA, Morrison HG, et al. (2010).The Transcriptional Response
to Encystation Stimuli in Giardia Lamblia Is Restricted to a Small Set of Genes. Eukaryotic cell 9 :
1566–1576. 10.1128 / EC.00100-10 - Samuelson J, Robbins P (2011) A simple fibril and lectin model for cyst walls of Entamoeba and
perhaps Giardia. Trends in parasitology 27: 17–22. 10.1016/j.pt.2010.09.002. - Konrad C, Spycher C, Hehl AB (2010) Selective condensation drives partitioning and sequential
secretion of cyst wall proteins in differentiating Giardia lamblia. PLoS Pathog 6: e1000835
10.1371/journal.ppat.1000835. - Ebneter JA, Heusser SD, Schraner EM, Hehl AB, Faso C (2016) Cyst-Wall-Protein-1 is fundamental for
Golgi-like organelle neogenesis and cyst-wall biosynthesis in Giardia lamblia. Nature
communications 7: 13859 10.1038/ncomms13859. - Bingham AK, Jarroll EL Jr., Meyer EA, Radulescu S (1979) Giardia sp.: physical factors of excystation
in vitro, and excystation vs eosin exclusion as determinants of viability. Experimental
parasitology 47: 284–291. - Schaefer FW 3rd, Johnson CH, Hsu CH, Rice EW (1991) Determination of Giardia lamblia cyst
infective dose for the Mongolian gerbil (Meriones unguiculatus). Applied and environmental
microbiology 57: 2408–2409. - J. Hohweyer , C. Cazeaux , E. travaille , E. Languet , A. Dumètre , D. Aubert , C. Terryn , JP Dubey , N.
Azas , M. Houssin , F. Loïc , I. Villena , S. Simultaneous Detection of the Protozoan Parasites
Toxoplasma, Cryptosporidium and Giardia in Food Matrices and Their Persistence on Basil Leaves.
Food Microbiol. , 57 ( 2016 ) , pp. 36 – 44. - J. Hohweyer , C. Cazeaux , E. travaille , E. Languet , A. Dumètre , D. Aubert , C. Terryn , JP Dubey , N. Azas , M. Houssin , F. Loïc , I. Villena , I., La carbona, S., 2016. Simultaneous detection of the protozoan parasites Toxoplasma, Cryptosporidium and Giardia in food matrices and their persistence on basil leave. Food Microbiol. 57, 36-44.
- Semenza, J. C., Herbst, S, Rechenburg, A., Suk, J.E., Höser, C., Schreiber, C., Kistemann, T., 852 2012.
Climate change impact assessment of food- and waterborne diseases. Crit. Rev. 853 Environ. Sci.
Technol. 42, 857-890. - S.M. Adl, A.G.B. Simpson, C.E. Lane, J. Lukeš, D. Bass, S.S. Bowser, M.W. Brown, F. Burki, M.
Dunthorn, V. Hampl, A. Heiss, M. Hoppenrath, E. Lara, L. le Gall, D.H. Lynn, H. McManus, E.A.D.
Mitchell, S.E. , L.W. Parfrey, J. Pawlowski, S. Rueckert, L. Shadwick, C.L. Schoch, A. Smirnov, F.W.
Spiegel The revised classification of eukaryotes. J. Eukaryot. Microbiol., 59 (2012), pp. 429-514, - D. Lloyd, J.C. Harris Giardia: highly evolved parasite or early branching eukaryote?Trends Microbiol.,
10 (2002), pp. 122-127 - D. He, O. Fiz-Palacios, C.-J. Fu, J. Fehling, C.-C. Tsai, S.L. Baldauf An alternative root for the eukaryote
tree of life. Curr. Biol., 24 (2014), pp. 465-470. - N. Arisue, M. Hasegawa, T. Hashimoto Root of the eukaryota tree as inferred from combined
maximum likelihood analyses of multiple molecular sequence data. Mol. Biol. Evol., 22 (2005), pp.
409-420. - J. Tovar, G. León-Avila, L.B. Sánchez, R. Sutak, J. Tachezy, M. van der Giezen, M. Hernández, M.
Müller, J.M. Lucocq Mitochondrial remnant organelles of Giardia function in iron-sulphur protein
maturation. Nature, 426 (2003), pp. 172-176. - K. Acosta-Virgen, B. Chávez-Munguía, D. Talamás-Lara, A. Lagunes-Guillén, A. Martínez-Higuera, A.
Lazcano, A. Martínez-Palomo, M. Espinosa-Cantellano Giardia lamblia : identification of
peroxisomal-like proteins. Exp. Parasitol., 191 (2018), pp. 36-43. - M. Marti, A. Regös, Y. Li, E.M. Schraner, P. Wild, N. Müller, L.G. Knopf, A.B. Hehl An ancestral secretory apparatus in the Protozoan parasite Giardia intestinalis. J. Biol. Chem., 278 (2003), pp. 24837-24848.
- C.V. Vranych, M.R. Rivero, M.C. Merino, G.F. Mayol, N. Zamponi, B.A. Maletto, M.C. Pistoresi
Palencia, M.C. Touz, A.S. Rópolo Simylation and deimination of proteins: two epigenetic
modifications involved in Giardia encystation Biochim. Biophys. Acta Mol. Cell Res., 1843 (2014), pp.
1805-1817. - T.B. Nicholson, N. Veland, T. Chen Writers, readers, and erasers of epigenetic marks. Epigenetic
Cancer Ther, Elsevier (2015), pp. 31-66. - S. Sonda, L. Morf, I. Bottova, H. Baetschmann, H. Rehrauer, A. Caflisch, M.-A. Hakimi, A.B. Hehl
Epigenetic mechanisms regulate stage differentiation in the minimized protozoan Giardia lamblia
Mol. Microbiol., 76 (2010), pp. 48-67. - A. Salusso, N. Zlocowski, G.F. Mayol, N. Zamponi, A.S. Rópolo Histone methyltransferase 1 regulates
the encystation process in the parasite Giardia lamblia FEBS J., 284 (2017), pp. 2396-2409. - K.T. Kim, M.T.S. Mok, M.R. Edwards Protein kinase B from Giardia intestinalis Biochem. Biophys. Res.
Commun., 334 (2005), pp. 333-341. - C.A. Niño, J. Chaparro, P. Soffientini, S. Polo, M. Wasserman Ubiquitination dynamics in the early
branching eukaryote Giardia intestinalis. Microbiologyopen, 2 (2013), pp. 525-539. - A. Gavrilov, E. Eivazova, I. Pirozhkova, M. Lipinski, S. Razin, Y. Vassetzky Chromosome conformation
capture (from 3C to 5C) and its chip-based modification. Methods Mol. Biol (2009), pp. 171-188. - C.G. Prucca, I. Slavin, R. Quiroga, E.V. Elías, F.D. Rivero, A. Saura, P.G. Carranza, H.D. Luján Antigenic
variation in Giardia lamblia is regulated by RNA interference. Nature, 456 (2008), pp. 750-754. - W.J. Sullivan, A. Naguleswaran, S.O. Angel Histones and histone modifications in protozoan
parasites. Cell. Microbiol., 8 (2006), pp. 1850-1861. - J. Ankarklev, J. Jerlström-Hultqvist, E. Ringqvist, K. Troell, S.G. Svärd Behind the smile: cell biology and disease mechanisms of Giardia species. Nat. Rev. Microbiol., 8 (2010), pp. 413-422.
- T. Lauwaet, B.J. Davids, D.S. Reiner, F.D. Gillin Encystation of Giardia lamblia: a model for other
parasites. Curr. Opin. Microbiol., 10 (2007), pp. 554-559. - E. Einarsson, K. Troell, M.P. Hoeppner, M. Grabherr, U. Ribacke, S.G. Svärd Coordinated changes in
gene expression throughout encystation of Giardia intestinalis. PLoS Neglected Trop. Dis., 10 (2016). - A. Salusso, N. Zlocowski, G.F. Mayol, N. Zamponi, A.S. Rópolo Histone methyltransferase 1 regulates
the encystation process in the parasite Giardia lamblia. FEBS J., 284 (2017), pp. 2396-2409. - C.A. Niño, J. Chaparro, P. Soffientini, S. Polo, M. Wasserman Ubiquitination dynamics in the early
branching eukaryote Giardia intestinalis .Microbiologyopen, 2 (2013), pp. 525-539. - C.A. Niño, C.G. Prucca, J. Chaparro, H.D. Luján, M. Wasserman. The ubiquitin-activating enzyme (E1)
of the early-branching eukaryote Giardia intestinalis shows unusual proteolytic modifications and
play important roles during encystation. Acta Trop., 123 (2012), pp. 39-46. - C.G. Prucca, I. Slavin, R. Quiroga, E.V. Elías, F.D. Rivero, A. Saura, P.G. Carranza, H.D. Luján. Antigenic
variation in Giardia lamblia is regulated by RNA interference. Nature, 456 (2008), pp. 750-754. - A.A. Saraiya, W. Li, J. Wu, C.H. Chang, C.C. Wang. The microRNAs in an ancient protist repress the
variant-specific surface protein expression by targeting the entire coding sequence. PLoS Pathog., 10
(2014), Article e1003791.