Principio
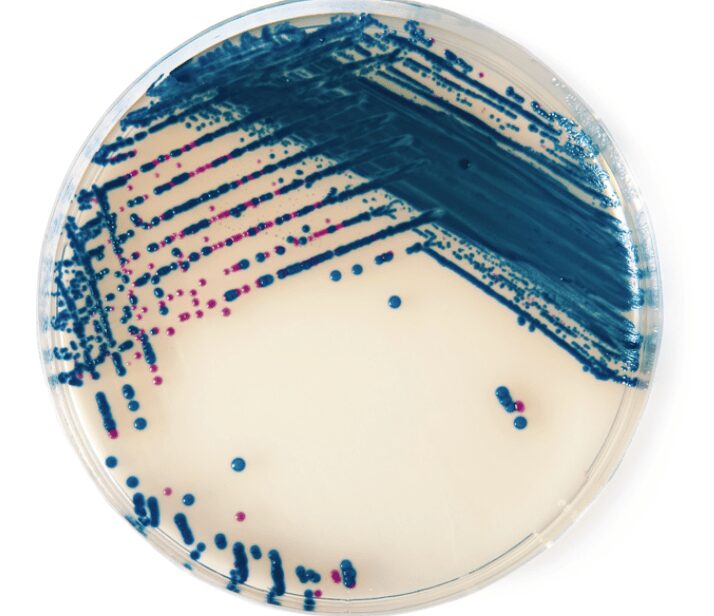
Lo StepB agar (Fig.1) è un terreno cromogeno per il differenziamento e l’isolamento degli streptococchi di gruppo B tra cui, molto noto, Streptococcus agalactiae.
Quest’ultimo, infatti, è causa di severe infezioni neonatali che interessano i bambini nelle prime tre settimane di vita (periodo estremamente delicato).
Siccome diversi studi dell’OMS (Organizzazione Mondiale della Sanità) mostrano che il 12-27% delle donne incita è interessato dal patogeno, diventa di sempre più vitale importanza rilevarne la presenza entro le 34-38 settimane di gestazione.
Per queste ragioni, il terreno di coltura StrepB risulta essere particolarmente indicato nella fase di screening preventivo.
Composizione e preparazione
Il terreno è dato da una base in polvere (B) e da due supplementi (S1 + S2) dalla seguente composizione (Tab.1):
| Prodotto = | Base (B) + | Supplemento (S1) + | Supplemento (S2) |
| Totale (g/l) | 44,70 | 8,00 | 0,25 |
| Composizione | Agar (15,0) Sali (7,5) Peptone ed estratto di lievito (20,0) Miscela cromogena (2,2) | Fattori di crescita (8,00) | Miscela selettiva (0,25) |
| Aspetto | Polvere | Liquido | Polvere |
| Conservazione | 15-30°C | 15-30°C | 2-8°C |
Il pH finale del mezzo deve essere di 7,3 +/- 0,2.
Per quanto riguarda la preparazione di 1 l di miscela, è necessario seguire questi passaggi:
Fase 1 (Base + S1)
- Sciogliere con attenzione 44,7 g di polvere base (B) in 1 l di acqua purificata;
- Aggiungere 8 ml di supplemento (S1);
- Mescolare fino a quando l’agar non si solidifica del tutto;
- Autoclavare a 121°C per 15 minuti;
- Far raffreddare fino a 45-50°C, in agitazione.
Fase 2 (S2)
- Versare in un recipiente trasparente 250 mg di supplemento (S2) e 10 ml di acqua purificata;
- Mettere in agitazione fino al complemento scioglimento di S2.
Fase 3 (Base + S1 + S2)
- Filtrare asetticamente S2 e aggiungerne 10 ml alla fase 1 (Base + S1) raffreddata a 45-50°C;
- Mescolare delicatamente per omogenizzare.
Fase 4 (Versamento)
- Versare la fase 3 (Base + S1 + S2) in una piastra Petri;
- Lasciar solidificare fino a che il mezzo diventa trasparente.
Fase 5 (Conservazione)
- Conservare al buio prima dell’utilizzo;
- Il terreno pronto può essere conservato per un giorno a temperatura ambiente, oppure per un mese se refrigerato a 2-8°C (sempre al buio).
Metodo
I campioni utilizzabili possono essere di diversa natura, come campioni urinari, rettali o vaginali. Questi possono essere direttamente seminati sul terreno, previo un passaggio in brodo d’arricchimento (es. Todd Hewitt).
Se il terreno è stato refrigerato, prima di seminarci i campioni, è consigliabile riportarlo a temperatura ambiente.
Dopo aver seminato il campione, il terreno va incubato a 35-37°C per 18-24 h, in condizione di aerobiosi.
Risultati attesi
La lettura delle colonie sul terreno StrepB agar è puramente qualitativa.
L’interpretazione è riportata nella Tab.2 seguente:
| Microrganismo | Aspetto delle colonie |
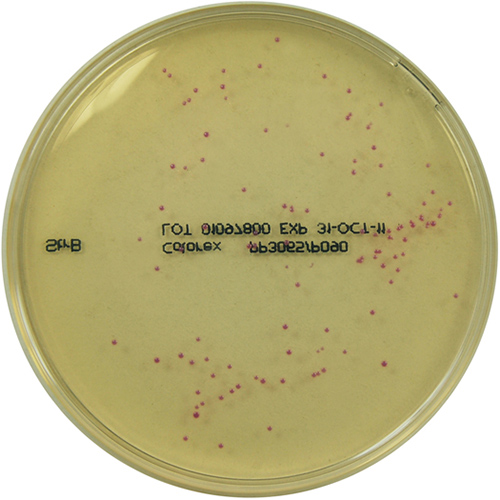
| Streptococcus agalactiae (Gruppo B) | fucsia, violette |
| Enterococcus spp. | blu metalliche |
| Lactobacilli, Leuconostoc Lactococci | rosa chiare parzialmente inibiti |
| Altri microrganismi | blu, incolori o inibite |
Immagini
I risultati della crescita sono osservabili in Fig. 2–3:

Limitazioni
Ci sono diverse limitazioni dello StrepB agar che vanno conosciute:
- La sua incubazione in atmosfera arricchita con CO2 può dare falsi positivi;
- L’identificazione finale di S. agalactiae va comunque data con le conferme di test biochimici (es. CAMP test), immunologici (Es. agglutinazione del lattice) e in spettrofotometria di massa (Es. Maldi-Tof);
- Alcuni e rari ceppi di streptococchi di gruppo B possono richiedere ulteriori 24 h di incubazione per formare colonie visibili;
- Specifici microrganismi come Aerococcus, Lactobacillus e Leuconostoc possono formare colonie violette chiare, confondibili con quelle di S. agalactiae.
- La maggior parte degli streptococchi di gruppo A formano colonie fucsia/violette che danno falso positivo. Tuttavia, si possono differenziare da quelle del gruppo B tramite il PYR test (PYR test positivo –> Gruppo A, PYR test negativo –> Gruppo B);
- Alcuni stafilococchi possono formare colonie violette differenziabili, tuttavia, tramite il test della catalasi (catalasi negativa –> streptococchi gruppo B, catalasi positiva –> stafilococchi).
Controllo qualità
Per il controllo qualità di StrepB agar si possono sfruttare i microrganismi riportati in Tab.3:
| Microrganismi | Aspetto delle colonie |
| S. agalactiae ATCC® 12386 | violette |
| S. agalactiae ATCC® 13813 | violette |
| E. faecalis ATCC® 29212 | blu metallico |
| E. coli ATCC® 25922 | inibito |
Fonti
Crediti immagini
- Immagine in evidenza: tpm-tpm.com.tw;
- Figura 1: tpm-tpm.com.tw;
- 2: eolabs.com;
- 3: Bio-Rad Laboratories.
Crediti tabelle
- Tabella 1–2–3: CHROMagar Scheda Tecnica.