Caratteristiche
La famiglia Poxviridae è composta da virus a DNA a doppio filamento (dsDNA) e include due sottofamiglie, cioè Chordopoxvirinae e Entomopoxvirinae; i primi infettano i vertebrati, i secondi colpiscono gli invertebrati. Ci sono quattro generi specifici dell’essere umano, ovvero Molluscipoxvirus, Orthopoxvirus, Parapoxvirus e Yatapoxvirus;
- nel primo rientra il virus del mollusco contagioso (Molluscum contagiosum virus, MCV);
- nel secondo sono compresi il virus del vaiolo delle scimmie (Monkeypox virus, MV) e il virus del vaiolo umano;
- il terzo include il virus della dermatite pustolare contagiosa (Orf virus), che causa un’infezione prevalentemente negli ovini e caprini, ma può essere trasmesso all’essere umano;
- il quarto comprende il Tanapox virus (o Yaba-like disease virus, YLDV) e il virus del tumore della scimmia (Yaba monkey tumor virus), responsabili di infezioni negli umani e nei primati dell’Africa equatoriale.
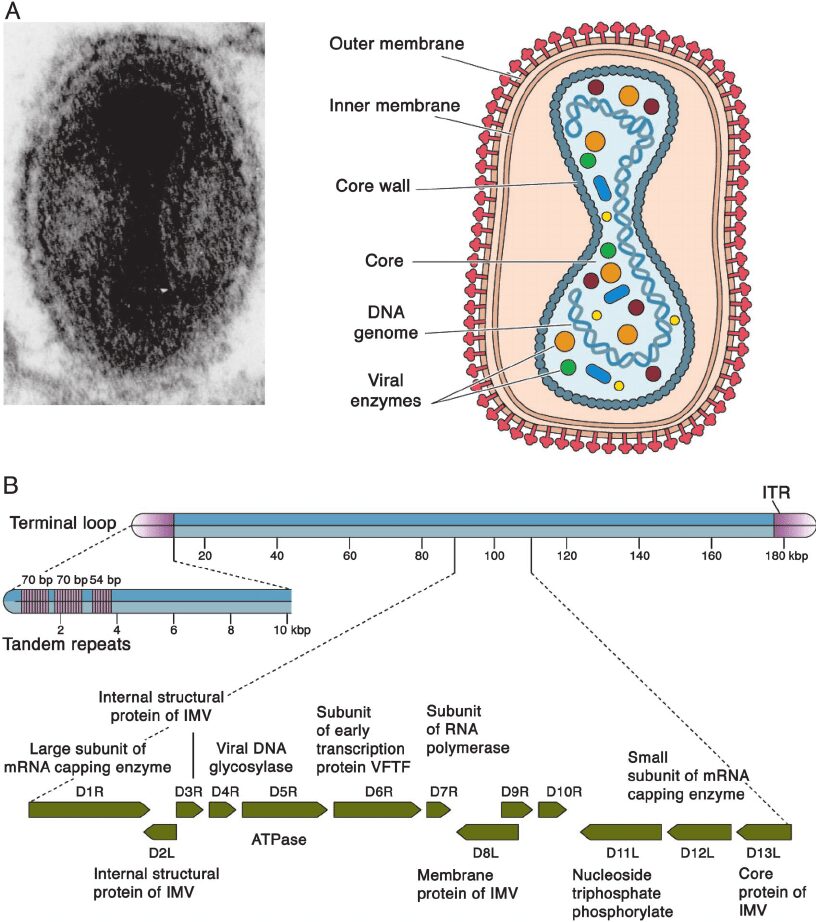
Le particelle virali dei poxvirus sono grandi e complesse, hanno un genoma dsDNA lineare di 130-300 Kbp, possiedono un pericapside formato da molteplici strati di membrane modificate (Fig. 1A), contengono più di 100 proteine (tra cui 10 enzimi) e cambiano forma e dimensioni in base alle specie e alla maturazione (Fig. 2). Se osservati al microscopio elettronico, all’esterno della cellula presentano una forma a manubrio, mentre appaiono a forma tondeggiante e compatta all’interno della cellula. Le dimensioni del capside sono circa 200 nanometri in diametro e 300 nanometri in lunghezza.
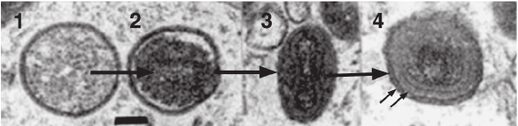
La replicazione dei poxvirus consta di diversi stadi (Fig. 3). Nel momento in cui il virus interagisce con il recettore presente sulla superficie della cellula bersaglio (probabilmente i glicosaminoglicani, GAGs), penetra nella cellula e viene privato della membrana esterna; in seguito il capside si apre e rilascia nel citoplasma l’acido nucleico.
Per quanto concerne l’espressione genica, si compone di due fasi: i primi geni ad essere espressi sono quelli precoci, che codificano per le proteine non strutturali, ovvero gli enzimi che permettono la replicazione del genoma virale. Una volta avvenuta la duplicazione del patrimonio genetico, vengono espressi i geni tardivi, i quali codificano per le proteine che compongono il capside. L’assemblaggio delle particelle virali si verifica nel citoscheletro della cellula, ed è un processo che attualmente è ancora non ben compreso.
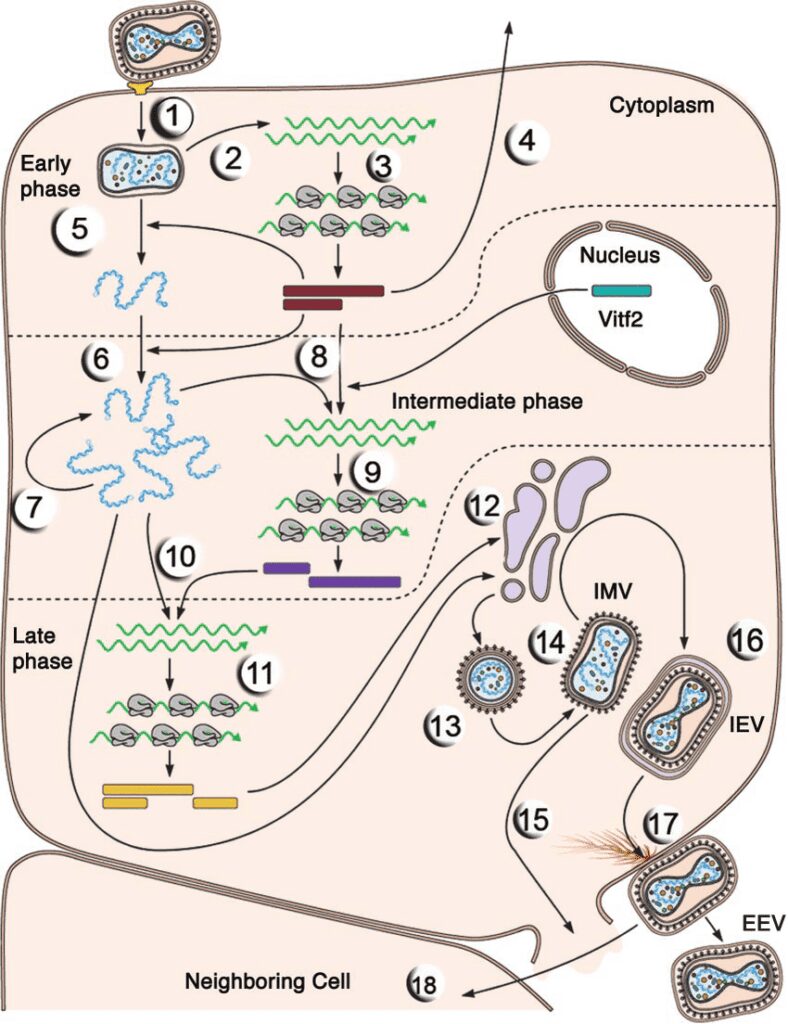
Un aspetto singolare di questa famiglia di virus è che, contrariamente agli altri virus a DNA a doppia elica, non si replicano nel nucleo (che fornisce le DNA-polimerasi), bensì nel citoplasma, dal momento che nel loro genoma è inclusa una sequenza codificante per una DNA-polimerasi DNA-dipendente.
Il vaiolo e la creazione del vaccino
Se parliamo dei poxvirus, non dobbiamo dimenticare il vaiolo umano, una patologia altamente contagiosa e aggressiva (fatale nel 25-50% dei casi), caratterizzata da febbre, malessere e lesioni cutanee su viso e corpo. Il vaiolo fu responsabile di grandi epidemie e raffigura la prima malattia infettiva che è stata eradicata grazie all’introduzione della vaccinazione.
L’ultimo caso diagnosticato fu in Somalia nel 1977, e nel 1980 l’Organizzazione Mondiale della Sanità (OMS) dichiarò la completa scomparsa della malattia. Questa patologia è nota da secoli, era presente già nell’antico Egitto; pensiamo ad esempio al faraone Ramses V, il quale morì di vaiolo nel 1000 a.C. É probabile che il vaiolo sia stato introdotto in Europa nel III secolo e portata in America dai Conquistadores ai primi del 1500. La popolazione degli Aztechi venne sconfitta in seguito a una pandemia di vaiolo, e in due anni ci furono 3,2 milioni di decessi. Ciò avvenne perché i nativi americani, rispetto agli europei, non erano dotati di anticorpi contro il virus.
Nell’Inghilterra del 1700 il 25% dei bambini moriva di vaiolo, e nel 1950, in India, più di 41000 persone vennero uccise da questa malattia.
Il primo a creare il vaccino contro il vaiolo fu il medico e naturalista inglese Edward Jenner (Fig. 4) nel 1798; egli aveva osservato che le mungitrici si ammalavano di vaiolo bovino (una forma meno severa rispetto a quello umano), e che dopo la guarigione, non sviluppavano più la malattia. Così Jenner, convinto che il contatto con il vaiolo bovino proteggesse dalla patologia, prelevò del materiale da pustole di vaiolo bovino e le inoculò in un bambino di otto anni, James Phipps (Fig. 5). Questi, dopo un periodo di convalescenza con rialzo febbrile e lesione cutanee locali, si riprese totalmente. Due mesi dopo Jenner prese del materiale da un caso di vaiolo umano e lo iniettò nel ragazzo, il quale non si ammalò; aveva sviluppato un’immunità verso il virus.
A questo punto Jenner mandò alla Royal Society un articolo in cui descriveva le sue osservazioni; il chirurgo Everard Home stilò un rapporto in cui manifestava il suo scetticismo e incitava ulteriori controlli e vaccinazioni. Vennero eseguiti gli studi aggiuntivi richiesti, e nel 1798 Jenner pubblicò un’analisi in cui erano riportati 23 “casi”, incluse varie persone che, dopo essere state inoculate con vaiolo bovino, erano protette dall’esposizione naturale.
Lo scienziato concluse che la somministrazione di vaiolo bovino era un’alternativa all’iniezione del virus del vaiolo umano, e affermò che l’effetto protettivo sarebbe durato per tutta la vita. Quest’ultima asserzione si sarebbe rivelata sbagliata.


Filogenesi
Dominio Varidnaviria
Regno Bamfordvirae
Phylum Nucleocytoviricota
Classe Pokkesviricetes
Ordine Chitovirales
Famiglia Poxviridae
Patogenesi
In questa parte dell’articolo ci si focalizzerà sulle malattie provocate dai cinque poxvirus citati all’inizio (Molluscum contagiosum virus, Monkeypox virus, Orf virus, Tanapox virus e Yaba monkey tumor virus).
Mollusco contagioso
L’agente responsabile è il Molluscum contagiosum virus (MCV), che causa un’infezione solitamente benigna che colpisce la cute. È caratterizzata dalla comparsa lesioni nodulari singole o multiple (Fig. 6), somiglianti a verruche, che possono formarsi in qualsiasi parte del corpo (faccia, collo, gambe, addome, aree genitali), e sono dovute a ipertrofia dello strato basale dell’epidermide. I sintomi sistemici sono assenti. Queste lesioni, conosciute come Molluschi, sono piccole, rialzate, rosate, con un tappo centrale caseoso (il “corpo del mollusco”) che è possibile rimuovere mediante schiacciamento. In molte persone le dimensioni delle lesioni vanno da piccole quanto una capocchia di spillo a grandi quanto la gomma di una matita (da 2 a 5 millimetri di diametro). Possono diventare pruriginose, dolenti, arrossate e/o gonfie, e normalmente regrediscono in maniera spontanea nel giro di 6-12 mesi.

La trasmissione del virus può avvenire per contatto fisico diretto o attraverso oggetti contaminati, tra cui asciugamani, vestiti, rasoi, spugne da bagno, giocattoli, attrezzatura da piscina. Anche se l’agente patogeno può diffondersi mediante la condivisione di piscine, bagni, saune o altri ambienti bagnati e contaminati, ciò non è stato provato. I ricercatori che investigano su tale ipotesi credono che è più probabile che il virus si propaghi tramite scambio di asciugamani e altri oggetti in giro per una piscina o una sauna piuttosto che attraverso l’acqua.
Il mollusco contagioso ha la proprietà di essere auto-infettante, ovvero un individuo può favorire la comparsa di ulteriori lesioni in altre parti del proprio corpo toccando o grattando quelle già presenti; anche la rasatura e la depilazione possono contribuire alla comparsa di nuove lesioni in altre zone del corpo.
Essendo un virus che si diffonde per contatto diretto, i bambini dell’asilo o delle scuole elementari rientrano tra i soggetti più comunemente affetti. Inoltre, il mollusco contagioso rappresenta una malattia a trasmissione sessuale; molti casi di mollusco contagioso negli adulti sono causati da rapporti sessuali.
Il virus del mollusco contagioso rimane confinato nell’epidermide e non circola attraverso il corpo, di conseguenza la propagazione attraverso tosse o starnuti non si verifica.
L’infezione da MCV viene facilitata da tre condizioni specifiche:
- L’indebolimento del sistema immunitario (dovuto all’AIDS, al trattamento con farmaci immunosoppressori o chemioterapici). In questo caso le lesioni sono più grandi e più complicate da trattare. Tra l’altro, in condizioni di immunosoppressione, c’è un rischio più alto di infezioni secondari causate da batteri;
- La dermatite atopica a causa delle frequenti rotture della pelle. Per la stessa ragione, persone con questa malattia possono diffondere il mollusco contagioso su altre aree del corpo con maggiore probabilità;
- Permanenza in luoghi caratterizzati da un clima caldo e umido, e posti affollati.
Vaiolo delle scimmie
Il virus responsabile di questa malattia (Monkeypox virus) è stato scoperto per la prima volta nel 1958 quando due epidemie di una patologia simile a quelle causate dai poxvirus colpirono delle colonie di scimmie impiegate per la ricerca, e da quel momento l’agente patogeno venne chiamato “monkeypox”. Il primo caso umano di Monkeypox è stato registrato nel 1970 nella Repubblica Democratica del Congo durante un periodo di impegno intensificato per eliminare il vaiolo. Da allora il Monkeypox virus è stato documentato negli umani in altri paesi centrali e occidentali dell’Africa. Le infezioni umane da virus del vaiolo delle scimmie sono state attestate solo tre volte al di fuori dell’Africa: nel 2003 negli Stati Uniti d’America (47 casi), e nel 2018 nel Regno Unito (3 casi) e in Israele (1 caso).
Il serbatoio naturale di questo virus è ad oggi ignoto, tuttavia si sospetta che le specie di roditori africani giochino un certo ruolo nella trasmissione. Il virus è stato isolato solo due volte da un animale nella natura selvaggia; il primo caso fu nel 1985 in un roditore africano apparentemente malato (lo scoiattolo di corda) nella regione equatoriale della Repubblica Democratica del Congo. Il secondo caso fu nel 2012 in un cucciolo morto di cercocebo moro trovato nel Parco Nazionale Tai, in Costa d’Avorio.
Esistono due gruppi genetici (clade) di Monkeypox virus, quello dell’Africa centrale e quello dell’Africa occidentale; il primo provoca infezioni più gravi comparato al secondo e ha una mortalità più elevata. La diffusione da individuo a individuo è ben confermata per il primo clade, e limitata per quanto concerne il secondo.
Negli esseri umani i sintomi dell’infezione da Monkeypox virus sono simili, anche se più lievi, a quelli del vaiolo, e includono febbre, emicrania, dolori muscolari e spossatezza. La differenza maggiore tra i sintomi del vaiolo umano e quelli del vaiolo delle scimmie è che nel secondo si produce un rigonfiamento dei linfonodi (linfadenopatia). Il periodo di incubazione di solito va da 7 a 14 giorni.
Dopo 1 o 3 giorni dal rialzo febbrile, gli individui affetti sviluppano delle eruzioni cutanee, che iniziano sul viso per poi espandersi nel resto del corpo. Queste progrediscono in macule, papule, vescicole, pustole e croste (Fig. 7). La durata della malattia è tipicamente di 2-4 settimane. In Africa il Monkeypox virus può causare la morte di 1 persona infetta su 10.

La trasmissione del virus si verifica nel momento in cui una persona entra in contatto con un animale o un essere umano infetto, o tramite materiali contaminati. Il virus penetra nel corpo attraverso le lesioni cutanee (anche non visibili), il tratto respiratorio, e le membrane mucose (occhi, naso, bocca). La diffusione tra gli animali può avvenire in seguito a morsi o graffi, contatto diretto con fluidi corporei o lesioni da decubito, contatto indiretto con lesioni da decubito, per esempio mediante lettiere contaminate. Il contagio tra esseri umani si compie soprattutto mediante goccioline respiratorie, contatto diretto con fluidi corporei o lesioni da decubito, contatto indiretto con lesioni da decubito (attraverso vestiti e biancheria contaminati).
Dermatite pustolare contagiosa
Chiamata anche eritema contagioso, è una malattia esantematica provocata dall’Orf virus, che, come abbiamo già anticipato all’inizio, infetta le capre e le pecore, ma può essere trasmessa alle persone; si tratta quindi di una zoonosi. L’infezione dovuta a questo virus negli animali si manifesta con lesioni papulose a livello orale che progrediscono verso croste; gli animali infetti normalmente sviluppano le lesioni crostose intorno alle labbra, al muso e nella bocca, che talvolta sanguinano (Fig. 8). Tuttavia, possono essere coinvolte anche le zampe e le mammelle delle pecore.

Quando l’Orf virus colpisce gli esseri umani, invece, la malattia si presenta con lesioni ulcerative o noduli sulle mani. L’infezione da Orf virus si verifica in tutto il mondo, ovunque ci siano dei piccoli ruminanti.
Questo virus rimane confinato specificatamente nell’epidermide della cute. Le lesioni (una o poche) o i noduli compaiono sulle dita, sulle mani, o sugli avambracci, e all’inizio hanno l’aspetto di piccole papule, per poi andare incontro a ulcerazione (Fig. 9). Ulteriori sintomi includono febbre lieve, senso di fatica, gonfiore locale dei linfonodi. La dimensione delle lesioni è generalmente 2-3 centimetri, ma può arrivare anche fino a 5. Possono essere dolorose ma di solito si risolvono da sole senza lasciare cicatrici.

L’infezione umana da Orf virus avviene solitamente nel momento in cui la pelle lesa entra in contatto con il virus proveniente da animali infetti od oggetti contaminati. Attività che possono aumentare il rischio di infezione sono:
- Allattamento con biberon, sondino nasogastrico, o tosare capre e pecore;
- Carezzare o avere contatti casuali con animali infetti;
- Manipolare equipaggiamento contaminato, come finimenti e imbragature;
- Essere morsi da animali infetti.
L’Orf virus non è trasmesso da una persona infetta a un’altra, e l’infezione non genera un’immunità duratura, perciò un individuo può essere contagiato diverse volte nel corso della sua vita. Ciononostante, le infezione seguenti possono essere meno spiccate e guarire più velocemente.
Al momento non esiste un trattamento approvato per le infezione da Orf virus, ma è comunque importante tenere sotto controllo le lesioni (mantenendole asciutte e coprendole), al fine di prevenire infezioni secondarie da batteri. Ogni volta che si lavora con gli animali o durante i lavori manuali in cui le lesioni si possono bagnare, è opportuno usare fasciature impermeabili. Per permettere la guarigione, le lesioni non gocciolanti possono essere scoperte quando si va a dormire, o coperte con bende allentate se producono essudato.
Se si hanno sintomi come dolore o febbre, o si nota che le lesioni si stanno allargando rapidamente o diffondendo, si consiglia di contattare un medico.
È fondamentale ricordare che esistono multipli agenti patogeni che si trasmettono dagli ovini e dai caprini agli umani, e le lesioni cutanee, anche se hanno un aspetto similare a quelle causate dall’Orf virus, possono essere più gravi. Una di queste è l’antrace (provocata dal batterio Bacillus anthracis), che raffigura una malattia letale sia negli ovini che negli umani. È sempre consigliato farsi visitare da un medico quando si rileva una lesioni che non si conosce o se la lesione si ingrandisce velocemente.
Le persone che hanno un sistema immunitario indebolito possono sviluppare dei sintomi critici in seguito all’infezione da Orf virus, comprese grandi lesioni simil-tumorali (Fig. 10), malattia progressiva, comparsa di lesioni multiple, e reazioni eritematose multiformi tra cui sfoghi sulla cute e sulle membrane mucose.

Infezione da Tanapox virus
Si tratta di una malattia endemica nell’Africa equatoriale. Il virus responsabile è stato identificato nella pianura alluvionale del fiume Tana in Kenya durante due epidemie (nel 1957 e nel 1962) distinte da malattia febbrile acuta accompagnata da lesioni cutanee. Il periodo di incubazione negli esseri umani rimane tuttora ignoto, me se un individuo si inocula volontariamente il virus, l’eritema e l’ispessimento centrale appaiono nel giro di quattro giorni.
Gran parte delle persone affette presentano una febbre lieve che precede l’eruzione cutanea, della durata di 3-4 giorni, forti emicranie e dolori alla schiena, e sovente prurito nel punto in cui si sviluppa la lesione cutanea. Questa inizialmente appare come un piccolo nodulo, senza alcuna abrasione centrale, in seguito diventa papulare e si allarga gradualmente fino a raggiungere un diametro di circa 15 millimetri alla fine della seconda settimana di infezione (Fig. 11). Al quinto giorno dalla comparsa della lesione cutanea, i linfonodi si ingrossano e sono morbidi al tatto. La lesione rimane per lo più nodulare, tuttavia si ulcera durante la terza settimana per poi guarire progressivamente in 5 o 6 settimane, lasciando una cicatrice.

In Kenya, le lesioni sono quasi sempre singole e si trovano sulle braccia, sul viso, sul collo e sul dorso. Al contrario, nello Zaire il 22% dei pazienti ha lesioni multiple, di solito due o tre. Il numero massimo di lesioni rilevate in un individuo è dieci. Nel caso dei pazienti dello Zaire, le lesioni sono localizzate soprattutto sugli arti inferiori.
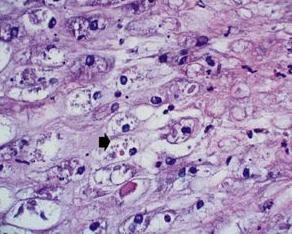
Negli esseri umani il Tanapox virus produce un aumento dello spessore dell’epidermide con degenerazione estesa delle cellule dello strato spinoso. Il citoplasma delle cellule rigonfie appare ripieno di corpi di inclusione pleomorfi, eosinofili di tipo B (conosciuti anche come corpi di Guarnieri) (Fig. 12). Anche i nuclei sono gonfi, con la cromatina concentrata nella periferia di essi.
Infezione da Yaba monkey tumor virus
Il primo caso di contagio da questo virus risale al 1956 e riguardò una colonia di macachi rhesus nel quartiere Yaba, a Lagos, in Nigeria. Sui corpi delle scimmie si erano formati dei tumori dai quali fu possibile isolare il virus e determinarne la specie (Yatapoxvirus). La patologia è contraddistinta dalla presenza di istiocitomi cutanei sulla faccia, sui palmi delle mani, sulle dita, sugli avambracci, sulla superficie del naso, sui seni nasali, sulle labbra e sul palato (Fig. 13). Questi tumori sono visibili nel giro di 3-4 giorni dall’infezione. Nei macachi rhesus hanno la tendenza a coinvolgere il viso e le cavità nasale causando la genesi di grandi tumori.


Gli istiocitomi si risolvono da soli in un periodo di 2 o 3 mesi dall’infezione. Attualmente la migliora terapia conosciuta è la rimozione cutanea e il successivo trattamento con antibiotici allo scopo di impedire l’infezione delle ferite aperte. In ogni caso, il metodo più idoneo per prevenire l’infezione da Yaba monkey tumor virus è indossare guanti e vestiti protettivi quando si interagisce con animali infetti.
Il virus è trasmissibile agli umani e in passato si è diffuso attraverso il contatto con le scimmie; i sintomi sono in genere gli stessi che si osservano nelle scimmie. I casi di virus trasmessi agli esseri umani non sono molti, e la documentazione è trascurabile.
Trattamento e prevenzione
Mollusco contagioso
Dal momento che questo tipo di infezione è autolimitante negli individui in buona salute, il trattamento può non essere necessario. Tuttavia, problemi legati alla visibilità delle lesione e il desiderio di prevenire la trasmissione possono invogliare il ricorso alla terapia. Questa è raccomandata solitamente se i molluschi sono localizzati su pene, vulva, vagina o ano; in questo caso è buona idea farsi visitare dal proprio medico, in quanto c’è la possibilità di avere un’altra malattia a trasmissione sessuale.
Tipologie di trattamento:
- Rimozione fisica mediante crioterapia (azoto liquido), raschiamento (si perfora il core e si raschia il corpo caseoso) e laser. Queste opzione possono richiedere l’anestesia e possono comportare dolore post-operatorio, irritazioni e cicatrici. È assolutamente sconsigliato provare a rimuovere le lesioni o i fluidi all’interno di esse da soli, poiché tale procedura può avere come conseguenza l’auto-inoculazione del virus in altre parti del corpo o il rischio di trasmetterlo ad altri. Inoltre, la scorticatura o il raschiamento della pelle possono causare infezioni batteriche;
- Terapia orale, che spesso è preferita per i pazienti pediatrici, in quanto è meno dolorosa e può essere eseguita a casa dai genitori in un ambiente meno minaccioso. La cimetidina orale è stata usata come trattamento alternativo per i bambini piccoli che sono spaventati dal dolore associato alla crioterapia, al raschiamento e al laser, o perché consente di evitare il rischio di cicatrici. Nonostante questo farmaco sia sicuro, indolore e ben tollerato, le lesioni facciali non rispondono bene come quelle presenti nel resto del corpo;
- Terapia topica, in cui rientrano diversi farmaci, ossia la crema basata sulla podofillotossina (Wartec), una tossina non alcaloide che appartiene al gruppo dei lignani, e raffigura il principio attivo della podofillina (la resina estratta dalle piante Podophyllum hexandrum e Podophyllum peltatum). Questa opzione, impiegata anche per i condilomi, è affidabile come terapia a domicilio per gli uomini, ma non è raccomandata per le donne incinte, data la presunta tossicità sul feto. Ogni lesione deve essere trattata individualmente.
- Un altro farmaco è il Molluskin 10, che contiene una soluzione altamente alcalina e corrosiva (la potassa caustica), e per cui deve essere applicata con un specifico pennello solo sui molluschi, e mai sulla cute sana.
- Ulteriori trattamenti sono l’acido salicilico, la tretinoina (un retinoide indicato nella cura dell’acne), la cantaridina (sostanza presente nelle ali anteriori dell’insetto Lytta vesicatoria. È usata anche per le verruche) e l’Imiquimod (un immunomodulatore che stimola la produzione di interferone alfa). Riguardo a quest’ultimo, non è stata verificata l’efficacia per il trattamento del mollusco contagioso nei bambini, e non è raccomandata per i più piccoli a causa dei possibili effetti avversi (prurito, eritema, bruciore, irritazione, ulcerazioni, erosioni).
Tutti i trattamenti topici sopra elencati devono essere prescritti dal medico.
- Terapia per soggetti immunocompromessi: persone aventi un sistema immunitario indebolito sovente non rispondono alle terapie tradizionali. Le terapie basate sul potenziamento del sistema immunitario si sono dimostrate le più efficaci per il mollusco contagioso nei pazienti immunodepressi. In casi estremi, la somministrazione di interferone all’interno delle lesioni è stata usata per trattare le lesioni facciali in questi pazienti. Ciononostante, gli effetti collaterali dell’interferone, come sintomi simil-influenzali, depressione e letargia, lo hanno reso un trattamento meno vantaggioso. Inoltre, l’interferone ha mostrato una maggiore efficacia nelle persone sane.
Al fine di prevenire la comparsa e/o la diffusione del mollusco, è appropriato seguire le seguenti norme igieniche: lavarsi le mani, non grattare le lesioni, coprirle con garze o bende, non condividere asciugamani, vestiti, spugne da bagno o rasoi, evitare sport di contatto (tranne se si riesce a coprire tutte le lesioni), non praticare rapporti sessuali se si hanno lesioni a livello genitale e anale.
Vaiolo della scimmia
Attualmente non c’è un trattamento provato e sicuro. Negli Stati Uniti, per questioni di controllo delle epidemie di Monkeypox, possono essere impiegati il vaccino per il vaiolo, gli antivirali e i trattamenti con immunoglobuline da individui vaccinati contro il vaiolo.
Per la profilassi, ci sono diverse disposizioni:
- Evitare il contatto con animali che potrebbero albergare il virus;
- Evitare di toccare materiali che possono essere stati a contatti con animali infetti (come lettiere);
- Isolare i pazienti affetti da altri che potrebbero essere a rischio di infezione;
- Buona igiene delle mani dopo contatto con animali infetti
- Uso di dispositivi di protezione individuale quando ci si prende cura dei pazienti.
La Food and Drug Administration (FDA) ha approvato il vaccino JYNNEOSTM (conosciuto anche come Imvamune o Imvanex), che si basa sul virus del vaiolo attenuato per la prevenzione dell’infezione da Monkeypox virus.
Fonti
- “Virus Taxonomy: 2019 Release”, International Committee on Taxonomy of Viruses (ICTV), luglio 2019
- “Pathogenic Molluscum Contagiosum Virus Sequenced, in Antiviral Agents Bulletin”, Biotechnology Information Institute, agosto 1996
- Rimoin AW, Mulembakani PM, Johnston SC, et al., “Major increase in human monkeypox incidence 30 years after smallpox vaccination campaigns cease in the Democratic Republic of Congo”, Proc Natl Acad Sci U S A., vol. 107, n. 37, 14 settembre 2010
- Tognotti E., “The eradication of smallpox, a success story for modern medicine and public health: What lessons for the future?” J Infect Dev Ctries, vol. 4, n. 5, giugno 2010
- Sonia Shah, “Nuova Minaccia dai Poxvirus”, Le Scienze 537 (maggio 2013)
- I.Bailey, E. Jenner, “Edward Jenner (1749-1823): naturalist, scientist, country doctor, benefactor to mankind”, J Med Biogr, vol. 4, n. 2, Mag 1996
- D. Baxby, “Edward Jenner’s unpublished cowpox inquiry and the Royal Society: Everard Home’s report to Sir Joseph Banks”, Med Hist, vol. 43, n. 1, gennaio 1999
- D. Baxby, E. Jenner, “Edward Jenner’s Inquiry; a bicentenary analysis”, Vaccine, vol. 17, n. 4, gennaio 1999
- Stephen C. Harrison, Bruce Alberts, Ellie Ehrenfeld, Lynn Enquist, Harvey Fineberg, Steven L. McKnight, Bernard Moss, Michael O’Donnelli, Hidde Ploegh, Sandra L. Schmid, K. Peter Walter, and Julie Theriot. 2004. “Discovery of antivirals against smallpox”, Proceedings of the National Academy of Sciences
- Martina Murdolo. 2012. “Medicina di laboratorio”, UniversItalia
- https://www.cdc.gov/poxvirus/molluscum-contagiosum/index.html
- https://www.cdc.gov/poxvirus/monkeypox/index.html
- https://www.cdc.gov/poxvirus/orf-virus/index.html
- https://www.wikiwand.com/it/Ectima_contagioso
- https://en.wikipedia.org/wiki/Tanapox
- Damian Dhar, M.D., Andrew E. Werchniak, M.D., Yu Li, Ph.D., Jeoffry B. Brennick, M.D., Cynthia S. Goldsmith, M.S., Richard Kline, M.S., Inger Damon, M.D., Ph.D., and Sidney N. Klaus, M.D. 2004. ”Tanapox Infection in a College Student”, The New England Journal of Medicine
- https://en.wikipedia.org/wiki/Yaba_monkey_tumor_virus
- https://www.palermotoday.it/blog/una-finestra-sulla-palermo-che-fu/virus-vaiolo-storia-palermo-vaccino.html
- http://www.unife.it/scienze/lm.biomolecolare/insegnamenti/virologia/materiale-didattico/13-dna-e-poxvirus.pdf
- https://it.wikiquote.org/wiki/Edward_Jenner
- https://scienzaesalute.blogosfere.it/post/569222/ectima-contagioso-quali-sono-i-sintomi
- https://www.elsevier.es/en-revista-medicina-familia-semergen-40-articulo-lesion-dianiforme-ampollosa-mano-un-S1138359316001155
- https://www.who.int/emergencies/outbreak-toolkit/disease-outbreak-toolboxes/monkeypox-outbreak-toolbox
- https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/yaba-monkey-tumor-virus