SARS-CoV-2 e sintomatologia gastrointestinale
La malattia CoVID-19 è un’infezione respiratoria acuta causata dal coronavirus SARS-CoV-2 scoperto a Wuhan a fine 2019. Come oramai noto, i sintomi che caratterizzano le persone infette dal virus sono tosse, febbre e, nei casi più gravi, difficoltà respiratorie.
Tuttavia, è stato visto che la sintomatologia gastrointestinale in pazienti SARS-CoV-2 positivi, quali nausea, vomito, diarrea e dolori addominali, si presenta con una percentuale variabile. Inoltre, tracce di RNA virale è stato ritrovato in campioni fecali di persone infette dal SARS-CoV-2 anche quando il tampone orale risultava negativo e i pazienti erano dimessi dall’ospedale. Infine, pochi ma promettenti dati dimostrano che contagiati da SARS-CoV-2 presentano un’alterazione del microbiota intestinale, suggerendo che una terapia probiotica mirata possa rappresentare una potenziale terapia per migliorare il decorso della polmonite, ipotesi sostenuta anche dai recenti studi riguardo l’asse intestino-polmoni.
Dati osservazionali
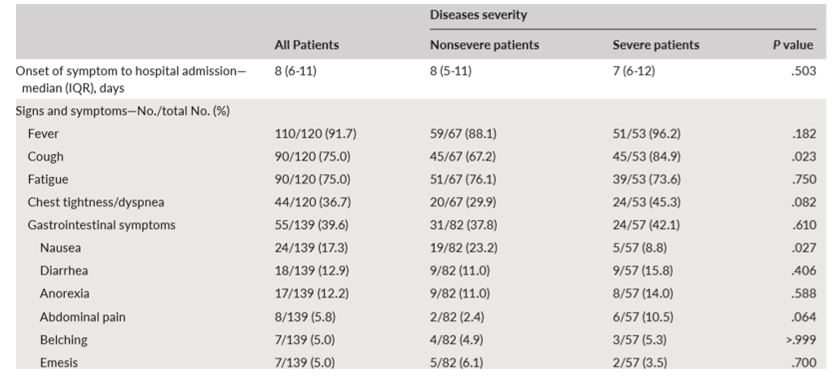
Uno studio svolto a Wuhan su 140 partecipanti infetti da SARS-CoV-2, ha evidenziato che il 39.6% dei pazienti presentava sintomatologia gastrointestinale, quali diarrea, nausea, anoressia, vomito, dolore addominale e/o rigurgito (Fig.1)
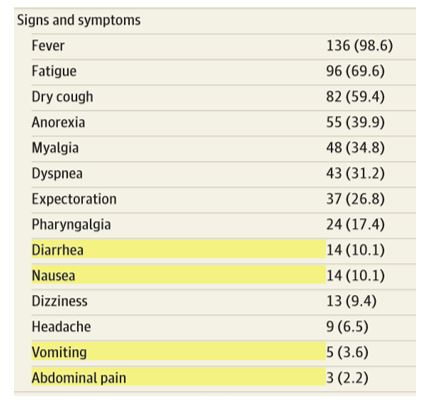
Un altro studio con una popolazione di 138 persone infette da SARS-CoV-2 ha dimostrato che il 10,1% dei partecipanti presentava sintomi gastrointestinali, in particolare diarrea e nausea si manifestavano pochi giorni prima lo comparsa di febbre e difficoltà respiratorie.
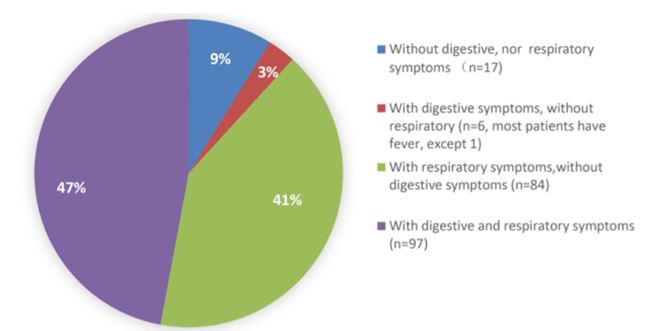
Ancora, uno studio osservazionale con una popolazione di 204 pazienti CoVID-19 positivi e ospedalizzati, ha dimostrato che il 50,5% presentava sintomi gastrointestinali, incluso la perdita di appetito. Escludendo quest’ultimo dall’analisi, poiché poco specifico come sintomo gastrointestinale, diarrea, vomito e dolori addominali si manifestavano nel 18,9% degli infetti. Inoltre, il periodo di ospedalizzazione di tali pazienti è risultato essere significativamente più lungo rispetto a quelli che non presentavano sintomi gastrointestinali.
SARS-CoV-2 RNA in campioni di feci: potenziale trasmissione oro-fecale
RNA virale di SARS-CoV-2 è stato identificato tramite tecniche di next-generation-sequencing nei campioni fecali di pazienti infetti. La presenza del virus nel tratto gastrointestinale è stata confermata anche dalla rilevazione del RNA virale in seguito a biopsia intestinale. Per citare alcuni esempi, uno studio ha evidenziato la presenza di SARS-CoV-2 RNA su 8 campioni fecali su 9; Xiao e altri hanno rilevato la presenza di RNA virale nelle feci di 39 su un totale di 73 pazienti positivi al tampone orale. Inoltre, il 23.29% presentavano risultati positive nelle feci anche quando il tampone orale era negativo ed i pazienti erano stati dimessi dall’ospedale. Tale evidenza indica che l’infezione virale persiste nonostante l’assenza del virus nel tratto respiratorio, e dunque, quella oro-fecale rappresenta una potenziale ulteriore via di trasmissione, soprattutto tra portatori asintomatici o persone con lievi sintomi gastrointestinali allo stato iniziale della malattia.
Interazioni SARS-CoV-2 e microbiota intestinale
I meccanismi per cui SARS-CoV-2 sia responsabile di sintomi gastrointestinali non sono chiari. Plausibili ipotesi sono le seguenti:
- SARS-CoV-2 invade il tratto gastrointestinale legandosi al recettore ACE2, analisi di immunofluorescenza hanno dimostrato che tale proteina è infatti presente anche nelle cellule epiteliali dello stomaco, duodeno e retto;
- La risposta infiammatoria contro il virus può essere responsabile di un danno alla mucosa intestinale;
- La presenza del virus nel tratto gastrointestinale, in particolare nel colon, è causa di alterazione dell’equilibrio microbico che caratterizza il microbiota intestinale in una condizione di eubiosi. Tale alterazione potrebbe essere fortemente responsabile di un’aumentata permeabilità intestinale e di una debole risposta immunitaria contro il virus (ricordiamo che fino all’80% nel nostro sistema immunitario risiede nel tratto gastrointestinale ed è in continua comunicazione con la microflora residente).
Ulteriore prova che rafforza il legame virus-microbiota, è la presenza di una di disbiosi caratterizzata una diminuzione di probiotici come lattobacilli e bifidobatteri. Tuttavia i dati non sono conclusivi, ulteriori analisi della composizione del microbiota intestinale in persone infette da SARS-CoV-2 sono indubbiamente necessari. Se potremo confermare l’intrinseco legame tra l’infezione virale e alterazione del microbiota intestinale, una terapia probiotica specifica potrebbe essere d’aiuto per prevenire e/o migliorare il decorso del CoVID-19. Sebbene per il momento non ci siano studi al riguardo, trials precedenti hanno dimostrato che pazienti con infezioni respiratorie causa di gravi polmoniti, hanno migliorato il loro decorso in seguito a trattamenti probiotici di Lactobacillus rhamnosus, Bacillus subtilis ed Enterococcus faecalis rispetto al placebo.
Asse intestino-polmoni: potenziale target terapeutico?
Recenti studi hanno evidenziato un reciproco cross-talk tra il sistema immunitario e componenti microbiche del tratto gastrointestinale e di quello respiratorio, tanto da parlare di un vero e proprio asse intestino-polmoni. Sebbene i meccanismi alla base di tale concetto debbano ancora essere delucidati, evidenze emergenti dimostrano che esista una migrazione delle cellule del sistema immunitario dall’intestino ai polmoni e che la manipolazione del microbiota stesso possa rappresentare un target terapeutico per il trattamento di patologie del tratto respiratorio
Conclusioni
I dati riguardo il ruolo del tratto gastrointestinale, in particolare del microbiota residente, nella patologia CoVID-19 non sono al momento sufficienti per trarre una conclusione consistente ed intraprendere una strategia terapeutica mirata. Ciononostante, i risultati degli studi emergenti sono promettenti ed evidenziano nuovamente l’importanza che svolge il microbiota intestinale nel benessere generale dell’individuo. L’analisi delle comunità microbiche di individui positivi al SARS-CoV-2 è fortemente auspicabile al fine di individuare pattern batterici comuni tra i contagiati e conseguentemente probiotici specifici per migliorare il decorso dell’infezione.
Per il momento ciò che la comunità scientifica ha di nuovo evidenziato è come prendersi cura del nostro tratto gastrointestinale e garantire il buon funzionamento del microbiota intestinale con un corretto stile di vita a partire da una dieta varia ed equilibrata, sia fondamentale per rafforzare le difese immunitarie contro agenti patogeni.
Inoltre, data la potenziale trasmissione oro-fecale del virus, soprattutto in assenza di sintomi, è motivo per sottolineare l’osservanza delle norme igieniche divulgate dall’OMS per ridurre il più possibile la diffusione del SARS-CoV-2.
Si ringrazia Elisa Pierella per il gentile contributo
Bibliografia
- Budden, K. F., Gellatly, S. L., Wood, D. L. A., Cooper, M. A., Morrison, M., Hugenholtz, P., & Hansbro, P. M. (2017). Emerging pathogenic links between microbiota and the gut-lung axis. Nature Reviews. Microbiology, 15(1), 55–63. https://doi.org/10.1038/nrmicro.2016.142
- Dang, A. T., & Marsland, B. J. (2019). Microbes, metabolites, and the gut–lung axis. Mucosal Immunology, 12(4), 843–850. https://doi.org/10.1038/s41385-019-0160-6
- Enaud, R., Prevel, R., Ciarlo, E., Beaufils, F., Wieërs, G., Guery, B., & Delhaes, L. (2020). The Gut-Lung Axis in Health and Respiratory Diseases: A Place for Inter-Organ and Inter-Kingdom Crosstalks. Frontiers in Cellular and Infection Microbiology, 10. https://doi.org/10.3389/fcimb.2020.00009
- Gao, Q. Y., Chen, Y. X., & Fang, J. Y. (2020). 2019 Novel coronavirus infection and gastrointestinal tract. Journal of Digestive Diseases, 21(3), 125–126. https://doi.org/10.1111/1751-2980.12851
- Gu, J., Han, B., & Wang, J. (2020). COVID-19: Gastrointestinal Manifestations and Potential Fecal–Oral Transmission. Gastroenterology, 158(6), 1518–1519. https://doi.org/10.1053/j.gastro.2020.02.054
- Mak, J. W. Y., Chan, F. K. L., & Ng, S. C. (2020). Probiotics and COVID-19: One size does not fit all. The Lancet Gastroenterology & Hepatology, 0(0). https://doi.org/10.1016/S2468-1253(20)30122-9
- Pan, L., Mu, M., Yang, P., Sun, Y., Yan, J., Li, P., Hu, B., Wang, J., Hu, C., Jin, Y., Niu, X., Ping, R., Du, Y., Li, T., Xu, G., Hu, Q., & Tu, L. (n.d.). Clinical characteristics of COVID-19 patients with digestive symptoms in Hubei, China: A descriptive, cross-sectional, multicenter study. 25.
- Wang, D., Hu, B., Hu, C., Zhu, F., Liu, X., Zhang, J., Wang, B., Xiang, H., Cheng, Z., Xiong, Y., Zhao, Y., Li, Y., Wang, X., & Peng, Z. (2020). Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China. JAMA, 323(11), 1061–1069. https://doi.org/10.1001/jama.2020.1585
- Xiao, F., Tang, M., Zheng, X., Liu, Y., Li, X., & Shan, H. (2020). Evidence for Gastrointestinal Infection of SARS-CoV-2. Gastroenterology, 0(0). https://doi.org/10.1053/j.gastro.2020.02.055
- Xie, C., Jiang, L., Huang, G., Pu, H., Gong, B., Lin, H., Ma, S., Chen, X., Long, B., Si, G., Yu, H., Jiang, L., Yang, X., Shi, Y., & Yang, Z. (2020). Comparison of different samples for 2019 novel coronavirus detection by nucleic acid amplification tests. International Journal of Infectious Diseases, 93, 264–267. https://doi.org/10.1016/j.ijid.2020.02.050
- Xu, K., Cai, H., Shen, Y., Ni, Q., Chen, Y., Hu, S., Li, J., Wang, H., Yu, L., Huang, H., Qiu, Y., Wei, G., Fang, Q., Zhou, J., Sheng, J., Liang, T., & Li, L. (2020). [Management of corona virus disease-19 (COVID-19): The Zhejiang experience]. Zhejiang Da Xue Xue Bao. Yi Xue Ban = Journal of Zhejiang University. Medical Sciences, 49(1), 0.
- Yan, R., Zhang, Y., Guo, Y., Xia, L., & Zhou, Q. (2020). Structural basis for the recognition of the 2019-nCoV by human ACE2. BioRxiv, 2020.02.19.956946. https://doi.org/10.1101/2020.02.19.956946
- Zhang, H., Kang, Z., Gong, H., Xu, D., Wang, J., Li, Z., Cui, X., Xiao, J., Meng, T., Zhou, W., Liu, J., & Xu, H. (2020). The digestive system is a potential route of 2019-nCov infection: A bioinformatics analysis based on single-cell transcriptomes. BioRxiv, 2020.01.30.927806. https://doi.org/10.1101/2020.01.30.927806
- Zhang, J.-J., Dong, X., Cao, Y.-Y., Yuan, Y.-D., Yang, Y.-B., Yan, Y.-Q., Akdis, C. A., & Gao, Y.-D. (2020). Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy. https://doi.org/10.1111/all.14238