Due settori complementari
La chimica farmaceutica è diventata negli ultimi anni un campo in forte espansione e costante crescita. La ricerca di nuovi principi attivi o il miglioramento dell’attività biologica delle molecole già note si avvale sempre più di tecniche sofisticate e complesse di sintesi, in cui anche la microbiologia può giocare un ruolo fondamentale. Un esempio è quello rappresentato dal processo di biocatalisi.
Le sfide della chimica farmaceutica
I target d’interesse farmacologico sono infatti macromolecole cellulari dotate di una precisa e complessa geometria tridimensionale, come enzimi, acidi nucleici e recettori di membrana. In particolare, porzioni o regioni specifiche di queste, ad esempio i siti di regolazioni allosterica o il sito attivo stesso nel caso di un enzima, entrambi costituiti da pochi e precisi residui amminoacidici.
Se grazie alle moderne tecniche di cristallografia a raggi X si hanno oggi a disposizione conoscenze e mappe sempre più approfondite di tali regioni e porzioni submolecolari, la sintesi di molecole che siano capaci d’interagire in modo specifico e selettivo con la porzione d’interesse di esse non può basarsi solo sui metodi classici della Chimica Organica. Le molecole target possiedono infatti un’orientazione spaziale dei propri gruppi funzionali “sinistra-destra” ben definita; sono capaci perciò di riconoscere ed interagire solo con altre molecole che abbiano una geometria a loro complementare, oltre che capaci d’instaurare le corrette interazioni in termini di legame chimico.
La chiralità
Le macromolecole biologiche di cui sono costituite tutte le cellule di tutti gli organismi viventi, a qualunque livello di complessità si considerino, sono infatti dotate di chiralità. Ciò significa che non hanno un asse di simmetria e non sono sovrapponibili alla loro immagine speculare.
Per esemplificare in generale il concetto di chiralità, se si considera anche solo un semplice amminoacido come può essere ad esempio l’alanina, si vede che:

La connettività degli atomi resta la stessa per entrambe le strutture, ma l’orientazione spaziale dei singoli atomi o gruppi di atomi (i cosiddetti:”gruppi funzionali”) cambia nei due casi. L’amminoacido cioè può esistere in due forme diverse. Le due forme vengono, rispettivamente, denominate:”Enantiomero R “ ed “Enatiomero S”.
Ovviamente anche le molecole d’interesse farmacologico hanno una loro caratterizzazione spaziale (stereochimica) precisa.
Il sito di legame presente sulla macromolecole target è capace di riconoscere spesso solo una delle due disposizioni spaziali. Quando una struttura chirale si trova ad interagire con il sito di legame si possono verificare, secondo la sua geometria, solo due possibilità:

La sintesi organica tradizionale porta all’ottenimento di prodotti in miscela racemica (cioè in cui i due enantiomeri, R ed S, sono presenti in proporzione 1:1) nella grande maggioranza dei casi. Però, solo uno dei due enantiomeri molto spesso presenta l’attività biologica desiderata o d’interesse.
Il problema delle molecole chirali
Quando si realizza un farmaco, ciò può essere un ostacolo. Isolare e purificare dalle miscele racemiche uno solo degli enantiomeri è infatti processo costoso e difficile. A volte non è necessario, poiché solo uno degli enantiomeri produce un effetto biologico mentre l’altro è innocuo. Questo accade ad esempio per l’Ibuprofene, in cui solo la forma S è quella dotata di attività antinfiammatoria.
Ci sono però anche moltissimi casi in cui l’enantiomero non desiderato ha invece un effetto marcatamente tossico anziché terapeutico. La talidomide, utilizzata largamente negli anni cinquanta come sedativo ed ipnotico e commercializzata allora come racemo, è il caso più eclatante al riguardo e tutt’ora studiato. Essa esplica il suo effetto sedativo quando in forma R, mentre l’enantiomero S è un potente teratogeno; questo ha portato alla nascita di molti bambini affetti da grave focomelia, quando ancora le conoscenze sull’argomento erano scarse e non c’era l’attenzione attuale su tali tematiche.
Ecco perchè alcuni farmaci sono venduti in miscela racemica, mentre per altri avere a disposizione un metodo di produzione che permetta di non ottenere un prodotto racemico, ma il più possibile enantiomericamente puro è un obiettivo che molte case farmaceutiche si prefiggono anche con investimenti mirati e cospicui.
Certamente esistono tecniche ben note in Chimica Organica che permettono d’ottenere un certo enantiomero come prodotto in misura maggiore rispetto all’altro. Tuttavia, tali reazioni necessitano di condizioni non sempre facili da ottenere; ad esempio alte temperature, condizioni di pH fortemente acidi o basici, soluzioni costituite da solventi chimici spesso tossici ed inquinanti ed infine l’uso di catalizzatori metallici anche molto costosi o rari (quali il Platino o il Rutenio, ad esempio).
Ed è qui che il Microbiologo può fornire il suo aiuto.
Una mano dalla microbiologia
Infatti, le reazioni chimiche a livello cellulare sono tutte catalizzate da enzimi, i quali sono catalizzatori proprio enantioselettivi. Riconoscono cioè un tipo di enantiomero di preferenza tra R ed S e possono dare prodotti finali di reazione che sono enantiomericamente puri (a gradi differenti, in base all’enzima) e non miscele racemiche.
Inoltre essi operano in condizioni quasi fisiologiche o comunque ben più blande di pH, a temperatura pressochè ambientale ed in soluzione acquosa.
Esiste un ben preciso settore della Chimica Farmaceutica che studia la possibilità di utilizzare enzimi isolati o addirittura cellule intere (fresche oppure liofilizzate) come catalizzatori per reazioni enantioselettive d’interesse. Qui la Microbiologia e la Chimica Organica s’incontrano ed è richiesta la collaborazione fianco a fianco d’esperti di entrambi i campi: la Biocatalisi.
La biocatalisi
Si parte da colture microbiche sia eucariotiche che procariotiche, a seconda del tipo di attività enzimatica coinvolta (ben caratterizzata in letteratura) e del tipo di prodotto che si vuole ottenere. A partire da ciò è possibile allestire una reazione in cui le cellule sono sospese in una miscela di reazione composta in modo molto semplice. In particolare, da un tampone che mantenga costante il pH (che normalmente si discosta di poco da quello fisiologico), da glucosio e dalla molecola d’interesse. Essa costituirà il substrato su cui gli enzimi cellulari andranno ad agire.
Quindi, questo avviene senza necessità di alte temperature, di condizioni di pH estreme, di altri catalizzatori e con una certezza maggiore di successo. Oltre che con una maggiore facilità nel recupero del prodotto voluto.
Se, a titolo d’esempio, si avesse un composto come quello nella figura seguente e si volesse ridurre il gruppo carbonilico a gruppo alcoolico, il risultato potrebbe essere il seguente:
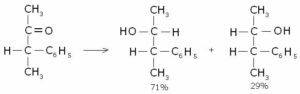
Appare evidente una resa percentuale tra i prodotti di uno dei due enantiomeri superiore all’altro in larga parte. Questo grazie allo sfruttamento della semplicità attività reduttasica di appositi enzimi che sono già naturalmente presenti ed espressi nella cellula.
Metodi di biocatalisi
E’ possibile utilizzare a tale scopo cellule intere, prelevate direttamente da coltura pura (preferibilmente colture in sospensione) e semplicemente lavate preventivamente in tampone prima dell’utilizzo. In alternativa, utilizzare cellule intere che sono state precedentemente liofilizzate e conservate per un certo periodo di tempo. Non è quindi necessario, come invece si faceva una volta, procedere per forza alla lisi cellulare ed alla purificazione del solo enzima che serve. Questa era una procedura spesso lunga e difficoltosa, come qualunque Biochimico sa bene.
Ciò semplifica molto sia i protocolli che soprattutto le tempistiche necessarie per ottenere il prodotto desiderato. Infatti, i tempi per tali reazioni si aggirano solitamente intorno alle 24/48 H al massimo.
E’ altrettanto possibile ovviamente procedere anche con tecniche d’ingegneria genetica. Quindi, clonare in batteri o lieviti i geni che esprimano l’attività enzimatica voluta e solitamente non presente allo stato nativo e poi procedere alla medesima tecnica. Si ottengono così ceppi di microrganismi ricombinanti ad hoc. Tuttavia molto spesso ciò non è necessario. Infatti, in letteratura sono ormai ben caratterizzate e descritte le attività enzimatiche di numerosi ceppi microbici di tutti i tipi. I più utilizzati in queste tecniche, poichè danno i risultati migliori, sono i lieviti del genere Saccharomyces. Non mancano molti esponenti degli Attinomiceti e numerosi altri ancora.
Integrare la microbiologia in un processo chimico multistep
Le molecole d’interesse farmaceutico sono in larga parte molto grosse e complesse. Hanno uno scheletro centrale, uno scaffold, che può essere costituito anche da decine di atomi a cui sono legati molti gruppi funzionali che possono avere funzione diversa, oltre a quelli, di solito pochi, che sono deputati all’interazione con la macromolecola bersaglio.
La loro sintesi è effettuata ormai pertanto tramite processi multistep, cioè a più passaggi, ottenendo di volta in volta più prodotti intermedi che poi vengono “montati” tra loro, proprio come si farebbe coi pezzi di un puzzle, per ottenere la molecola finale.
Negli step in cui particolare importanza è data all’ottenimento di prodotti che abbiano gruppi funzionali con la corretta orientazione spaziale e grado di chiralità, le tecniche della biocatalisi e l’apporto del microbiologo sono critici per la buona riuscita del lavoro finale. E, viste le tendenze e l’interesse delle Aziende Farmaceutiche, lo saranno sempre più in futuro.
Simone Rinaldi


