Il ruolo dei Funghi entomopatogeni
La protezione delle coltivazioni dagli insetti è stata sempre uno dei maggiori costi per l’agricoltura. Ogni anno, i Paesi dell’Unione Europea consumano circa 39.600 tonnellate di insetticidi per la difesa contro gli insetti nocivi. Comunque, per la protezione delle piante possono essere utilizzate varie altre pratiche oltre all’uso dei convenzionali insetticidi chimici. Fra loro si può evidenziare l’agricoltura di precisione, la resistenza indotta (tramite l’uso di ammendamenti del suolo e spray fogliari) e il controllo biologico, come viene indicato dalle linee guida europee. Il controllo biologico include ogni metodo, strumento e agente che utilizza organismi benefici. Degli organismi con effetto benefico si distinguono i funghi entomopatogeni, i quali parassitano gli insetti, li fanno ammalare e alla fine li eliminano.
Funghi entomopatogeni nella storia
Il primo tentativo di utilizzare funghi per il controllo degli insetti nocivi fu realizzato in 1888 in Russia, usando il fungo Metarhizium anisoplie per controllare la popolazione di Cleonus punctiventris. Molti decenni dopo, nuovi applicazioni furono inventate, fra le quali si distinguono il sovietico Boverin nel 1965, basato su Bauveria bassiana e Micar nel 1981, basato sul fungo Hirsutella thompsonii ed utilizzato negli Stati Uniti. Oggi, una vasta varietà di funghi viene commercializzata per il controllo degli insetti.

Meccanismo di infezione
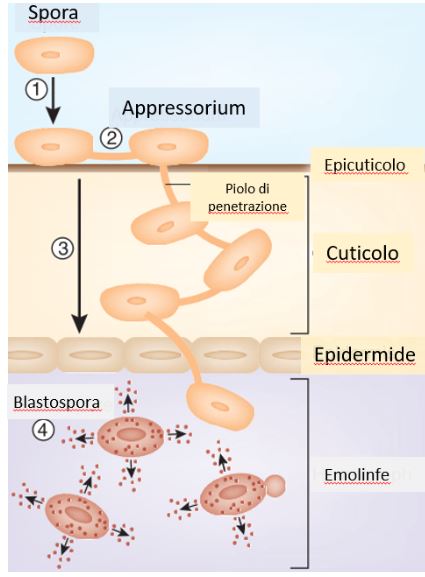
Il meccanismo in cui infestano gli insetti ospiti è stato ben studiato nel caso di Metarhizium sp. L’infezione inizia dai conidi, i quali si attaccano alla cuticola dell’insetto grazie alle interazioni idrofobe delle proteine trovate nella superficie dei conidi. Una volta attaccati, i conidi iniziano a germinare, formando un tubo. Il tubo cresce e si differenzia in un appressorio. L’appressorio è la formazione che permette un attaccamento rafforzato alla cuticola, usando proteine adesine. Appena il fungo completa la formazione dell’appressorio, può penetrare la cuticola utilizzando una miscela di enzimi. Fra questi enzimi, i più importanti sono le chitinasi per la depolimerizzazione di chitina, le lipasi per la decomposizione dei lipidi mentre le subtiline, tripsine, chimotripsine e carbossipeptidasi sono utilizzate per la degradazione delle proteine.
Quando il fungo entra nell’interno del corpo dell’ospite, può colonizzare l’emolinfa e usufruire dei nutrienti dissoluti in essa. In questa fase, il fungo reprime il sistema immunitario dell’ospite, mentre inizia la produzione del enzima trealasi per permettere l’utilizzo di trealosio. Il trealosio è il disaccaride più diffuso nell’emolinfa degli insetti.
L’utilizzo di funghi entomopatogeni
L’uso di funghi entomopatogeni ottiene risultati più sostenibili dai metodi convenzionali. I funghi non contaminano l’ecosistema con residui tossici e non alterano l’equilibrio dell’ecosistema. Comunque, i prodotti esistenti sono caratterizzati da un’efficienza limitata. La percentuale di mortalità è relativamente bassa ed è considerata insufficiente rispetto al livello di protezione offerto dagli insetticidi sintetici. Dopo l’infezione, gli insetti continuano a causare danni alle piante e in alcuni casi riescono anche a riprodursi, completando il loro ciclo di vita. In caso di riproduzione, i parassiti saranno presenti anche nella prossima stagione.
Funghi OGM e la tossina dello scorpione Androctonus australis
Per aumentare la loro efficienza, sono stati sviluppati funghi OGM, caratterizzati da letalità aumentata. Uno dei primi prodotti fu basato sul fungo Metarhizium acridum in cui fu introdotto il gene della tossina dello scorpione Androctonus australis L. In questo approccio, il fungo transgenico può esprimere la tossina di scorpione appena infesta l’insetto ospite, determinando una percentuale di mortalità elevata. Il fungo transgenico è stato già commercializzato in Paesi extracomunitari per il controllo della popolazione delle locuste.

Il veleno del bombo Bombus ignitus L
Un altro approccio di successo è stato l’introduzione del gene del veleno del bombo Bombus ignitus L nel fungo Bauveria bassiana. Il veleno del bombo dal punto di vista chimico include una proteasi di serine la quale induce la cascata metabolomica della fenolossidasi. Il risultato letale arriva dopo la melanizzazione della cuticola dell’insetto. Il vantaggio più importante in questo caso è che grazie alla velocità della melanizzazione, l’insetto ospite muore prima della riproduzione del fungo. In questa maniera, non rimangono microorganismi transgenici nel campo.

Questi due esempi indicano la metodologia più semplice per aumentare la letalità dei funghi entomopatogeni. Comunque, il loro uso include un certo livello di rischio ambientale. La loro applicazione incontrollabile potrebbe aumentare la popolazione di insetti resistenti sia alle tossine fungali sia alle tossine transgeniche. In più, è probabile che il loro uso avrà un impatto negativo nelle popolazioni di insetti utili. Nel caso dei funghi transgenici, un rischio assai evidente include la riproduzione fra i funghi già presenti nel ecosistema con quelli transgenici. Nonostante l’efficienza dei fungi transgenici, il loro uso è limitato in molti paesi. Nei Paesi appartenenti nell’Unione Europea l’uso di organismi OGM nell’agricoltura è severamente proibito.
Conclusione
In conclusione, l’uso di funghi entomopatogeni non può ancora sostituire i metodi convenzionali di protezione delle piante. A causa della loro efficienza limitata e le implicazioni sul loro miglioramento genetico, possono essere utilizzati solo come trattamenti aggiuntivi nella protezione delle coltivazioni.
Fonti
- Deng SQ, Cai Q Di, Deng MZ, Huang Q, Peng HJ. 2017. Scorpion neurotoxin AaIT-expressing Beauveria bassiana enhances the virulence against Aedes albopictus mosquitoes. AMB Express 7: 1–10.
- Kim JS, Choi JY, Lee JH, et al. 2013. Bumblebee Venom Serine Protease Increases Fungal Insecticidal Virulence by Inducing Insect Melanization. PLoS ONE 8: 2–8
- Lord JC. 2005. From Metchnikoff to Monsanto and beyond: The path of microbial control. Journal of Invertebrate Pathology 89: 19–29.
- Smit AB, Jager JH, Manshanden M, Bremmer J, European Parliament. European Parliamentary Research Service. Scientific Foresight Unit. 2021. Cost of crop protection measures : a follow-up to the study “The future of crop protection in Europe” (2021).
- Thomas MB, Read AF. 2007. Fungal bioinsecticide with a sting. Nature Biotechnology 25: 1367–1368.
- Wang C, St Leger RJ. 2007. A scorpion neurotoxin increases the potency of a fungal insecticide. Nature Biotechnology 25: 1455–1456.
- https://ec.europa.eu/eurostat/web/products-eurostat-news/-/ddn-20200603-1
- https://en.wikipedia.org/wiki/Cleonis
- https://betesdecompagnie.forumactif.org/t1658-androctonus-australis
- http://www.museum.osakafu-u.ac.jp/