La scienza della nutriepigenomica
La nutriepigenomica è una scienza che ha preso vigore negli ultimi tempi, la quale studia le funzioni preventive di alcuni nutrienti nell’ambito di diverse patologie, tramite il rimodellamento dell’epigenoma. Più precisamente, riguarda gli interventi nutrizionali specifici in grado di far regredire favorevolmente le alterazioni epigenetiche associate all’insorgenza di malattie croniche e altre condizioni patologiche.
È ormai noto che i nutrienti contenuti negli alimenti che mangiamo ogni giorno possono influenzare il genoma umano. Le conoscenze in questo campo stanno facendo passi da giganti. Assumere uno stile di vita salutare o, in modo opposto, caratterizzato dall’eccessivo consumo di cibo spazzatura può, rispettivamente, scoraggiare o favorire l’instaurarsi di processi fisiopatologici come la senescenza o la tumorigenesi.
Oggi sappiamo che questi fenomeni coinvolgono cruciali modificazioni epigenetiche, risentendo l’epigenetica degli stimoli ambientali, con effetti a lungo termine sullo stato di salute dell’organismo. Ma facciamo un passo indietro: che cos’è l’epigenetica?
L’epigenetica
Lo studio dell’epigenetica si occupa di studiare quel gruppo di informazioni che si integrano con il genoma senza alterare la sequenza nucleotidica del DNA, impattando sul fenotipo. Questi segnali possono provenire da fattori esogeni (intesi come lo stile di vita, l’alimentazione, l’assunzione di alcool, l’esposizione a fumo/farmaci/interferenti endocrini, lo stress, gli stati psicologici), i quali hanno una fortissima influenza sulla plasticità fenotipica. Le modificazioni apportate influenzano l’espressione genica, sono potenzialmente reversibili ma ereditabili di generazione in generazione (1).
Attraverso questi processi biochimici che avvengono “sopra” (epi- /ἐπί/ dal greco: sopra) la struttura del DNA e a livello dei residui amminoacidici delle proteine istoniche (ovvero proteine basiche su cui il DNA si avvolge), determinati geni possono essere “accesi” o “spenti”. Meccanismi finemente regolati decidono, quindi, quali set di geni debbano essere trascritti, in quale compartimento cellulare e quando.
Più in dettaglio, i meccanismi epigenetici comprendono la metilazione del DNA, le modificazioni post-traduzionali degli istoni, il coinvolgimento di complessi rimodellanti la cromatina, le sostituzioni degli istoni classici con varianti istoniche e l’azione dei microRNA (miRNA), di cui i primi due meccanismi sono i principali (2,3).
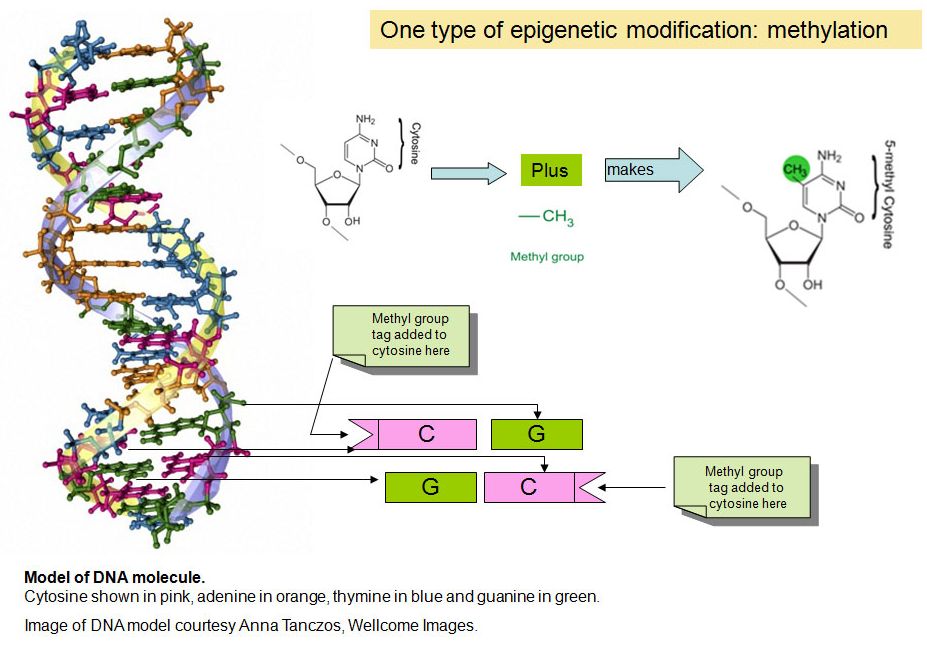
Il contributo epigenetico dei nutrienti
La letteratura raccoglie molti lavori su macro- e micronutrienti, soprattutto composti bioattivi (anche detti fitocomposti), in grado di modificare favorevolmente le risposte metaboliche ed avere effetti protettivi nel contesto di molte patologie (da cui il termine nutriepigenomica). Tra i vari composti è doveroso citare la genisteina della soia, la curcumina della curcuma, l’epigallocatechina 3-gallato (EGCG) del tè verde, la quercetina (presente in cipolle e vino), il resveratrolo dell’uva, il sulforafano delle piante crucifere, l’apigenina (presente nelle foglie di sedano e prezzemolo), la buteina (Rhus verniciflua), l’acido anacardico (negli oli di guscio degli anacardi) e alcune vitamine.
Il ruolo del resveratrolo nella nutriepigenomica
Tra i composti succitati, il resveratrolo è sicuramente un composto bioattivo che è stato ed è tutt’oggi oggetto di numerosi studi scientifici per le sue proprietà anti-infiammatorie, anti-aging e anti-microbiche. È uno stilbene presente in quantità apprezzabili nella buccia dell’uva rossa e nel vino rosso. In più basse concentrazioni si trova anche nei mirtilli, nelle arachidi e in alcuni prodotti erboristici. Il resveratrolo attenua lo stress ossidativo e l’effetto epigenetico si esplica attraverso la deacetilazione e l’accumulo nucleare di un gene chiamato FOXO3 (coinvolgendo la sirtuina SIRT1), che innesca la cascata di reazioni che regolano l’infiammazione e la morte cellulare, risultando anti-infiammatorio (4).
È bene soffermarsi sul ruolo della sirtuina SIRT1, enzima con attività di istone deacetilasi, in grado di controllare processi cellulari critici. Difatti, SIRT1 regola la produzione di insulina e glucosio, il metabolismo lipidico e la sopravvivenza cellulare ed è una molecola chiave nei meccanismi anti-aging indotti dalla restrizione calorica (5).
La restrizione calorica, anche per brevi periodi, riequilibra l’alterata metilazione (indotta dall’età) di geni coinvolti nei fenotipi degenerativi: il metabolismo è spostato verso una maggiore efficienza, con conseguente invecchiamento migliore e aumento della longevità. I composti attivanti le sirtuine sono stati identificati nel calcone buteina, negli stilbeni (come resveratrolo e piceatannolo), e nei flavonoidi. Questi ultimi includono la fisetina (che si trova comunemente nelle fragole e in altri frutti e verdure) e la quercetina (presente in capperi, vino, mele, tè, cipolle, agrumi, verdure e nella maggior parte delle bacche). Quest’ultima è un flavonolo che agisce con varie modalità, prima fra tutte si cita l’attività di trasformare i radicali dell’ossigeno in composti non radicalici, privi di reattività e quindi atossici (6). La sua attività epigenetica si esplica soprattutto a livello dell’acetilazione istonica: principalmente, diminuisce il livello della cicloossigenasi-2 (COX2), con conseguente silenziamento di geni pro-infiammatori (7).
La nutriepigenomica nello sviluppo fetale
Inoltre, arrivano sempre più evidenze riguardo al ruolo fondamentale della nutrizione sullo sviluppo fetale. Disordini come denutrizione, malnutrizione, obesità genitoriale o diabete gestazionale influiscono molto sulla riprogrammazione della prole in termini di metabolismo e di sviluppo cerebrale, proprio grazie all’eredità epigenetica.
Uno studio del 2015 ha dimostrato che il sovrappeso paterno prima del concepimento (più che quello materno) sarebbe in grado di alterare il pattern di metilazione del DNA dei nascituri, producendo spermatozoi con modifiche epigenetiche relative al rischio di sviluppare obesità, malattie cardiovascolari e metaboliche (8). Non solo l’esposizione intrauterina al diabete gestazionale materno produrrebbe regioni differenzialmente metilate nel genoma del feto, ma anche una dieta materna ad alto contenuto di grassi durante la gravidanza sarebbe n grado di alterare la struttura cromatinica fetale attraverso modificazioni degli istoni sui geni che controllano il metabolismo (9, 10).
La nutriepigenomica migliore: la dieta mediterranea
In ogni fase della vita e, a maggior ragione prima e durante la gravidanza, è importante assumere una dieta sana ed equilibrata in quanto la nutriepigenetica ci insegna che le abitudini alimentari possono modulare per ogni individuo il rischio di insorgenza di patologie. La stessa dieta mediterranea, patrimonio dell’UNESCO dal 2010 e scientificamente associata a una riduzione del rischio di incidenza di malattie cardiovascolari e di mortalità, è stata negli ultimi anni correlata anche ad effetti epigenetici protettivi quale un allungamento dei telomeri, strategia anti-aging connessa al rallentamento dei processi di invecchiamento (11, 12).
È stato, inoltre, dimostrato che l’aderenza a questo stile di vita induca cambi nello stato di metilazione di geni modulanti l’infiammazione e l’immunità in soggetti seguiti per un arco di tempo di 5 anni, in relazione all’attinenza al piano nutrizionale (13), sottolineando come gli interventi nutrizionali possano essere in grado di ottenere un effetto favorevole a livello preventivo.
Conclusioni sulla nutriepigenomica
La nutriepigenomica rappresenta un approccio emergente come possibile arma di prevenzione primaria. Ciò che la rende promettente è, prima di tutto, la reversibilità dei processi epigenetici, poi la possibilità di agire attraverso la modulazione di meccanismi che regolano l’espressione genica, senza però modificare il DNA stesso. Proprio per la novità che rappresenta, le prove di efficacia sono poche per permettere di stabilire in maniera assoluta il rapporto causa-effetto e, quindi, la solidità dei risultati.
Gli studi
Alcuni degli studi presenti in letteratura sono stati effettuati su modelli animali, i quali necessitano di essere confermati su ampie coorti di pazienti/soggetti sani per confermare l’effetto sull’uomo. Negli ultimi anni, comunque, numerosi studi hanno dimostrato l’efficacia di composti bioattivi nel trattamento di vari disordini metabolici. Ciò che è certo è che la qualità e la quantità degli alimenti che mangiamo ogni giorno sono dei fattori a cui prestare molta attenzione.
Basti pensare come, con il passare degli anni, le popolazioni orientali famose per la lunga aspettativa di vita, hanno avuto un repentino incremento di malattie coronariche, a seguito dell’occidentalizzazione delle loro abitudini alimentari, ovvero con il passaggio da una dieta ricca di grassi insaturi e a basso apporto calorico a una che abbonda in grassi saturi. Se saranno confermati i dati dei vari studi, si avrà un motivo ma anche una responsabilità individuale in più nel condurre la propria vita in modo salutare.
Fonti
- Zhang L, Lu Q, Chang C. Epigenetics in Health and Disease. Adv Exp Med Biol. 2020;1253:3-55. doi: 10.1007/978-981-15- 3449-2_1. PMID: 32445090
- Abi Khalil C. The emerging role of epigenetics in cardiovascular disease. Ther Adv Chronic Dis. Jul 2014;5(4):178-187 3. https://www.microbiologiaitalia.it/didattica/lepigenetica-e-espressione-genica-i-meccanismi-principali/ 4. Lin CH, Lin CC, Ting WJ, et al. Resveratrol enhanced FOXO3 phosphorylation via synergetic activation of SIRT1 and
- PI3K/Akt signaling to improve the effects of exercise in elderly rat hearts. Age (Dordr). 2014;36(5):9705 5. Cohen HY, Miller C, Bitterman KJ, et al. Calorie restriction promotes mammalian cell survival by inducing the SIRT1 deacetylase. Science. Jul 16 2004;305(5682):390-392
- Cai YZ, Mei S, Jie X, et al. Structure-radical scavenging activity relationships of phenolic compounds from traditional Chinese medicinal plants. Life Sci. May 15 2006;78(25):2872-2888
- Xiao X, Shi D, Liu L, et al. Quercetin suppresses cyclooxygenase-2 expression and angiogenesis through inactivation of P300 signaling. PLoS One. 2011;6(8):e22934
- Soubry A, Murphy SK, Wang F, et al. Newborns of obese parents have altered DNA methylation patterns at imprinted genes. Int J Obes (Lond). Apr 2015;39(4):650-657
- Godfrey KM, Sheppard A, Gluckman PD, et al. Epigenetic gene promoter methylation at birth is associated with child’s later adiposity. Diabetes. May 2011;60(5):1528-1534
- Franzago M, Fraticelli F, Stuppia L, et al. Nutrigenetics, epigenetics and gestational diabetes: consequences in mother and child. Epigenetics. Mar 2019;14(3):215-235
- Rosato V, Temple NJ, La Vecchia C, et al. Mediterranean diet and cardiovascular disease: a systematic review and meta analysis of observational studies. Eur J Nutr. Feb 2017;58(1):173-191
- Rafie N, Golpour Hamedani S, Barak F, et al. Dietary patterns, food groups and telomere length: a systematic review of current studies. Eur J Clin Nutr. Feb 2017;71(2):151-158
- Arpon A, Riezu-Boj JI, Milagro FI, et al. Adherence to Mediterranean diet is associated with methylation changes in inflammation-related genes in peripheral blood cells. J Physiol Biochem. Aug 2017;73(3):445-455