La prevenzione oncologica e il microbiota intestinale
Come afferma da tempo l’Organizzazione mondiale della sanità (Oms), con la corretta prevenzione e i corretti stili di vita, si potrebbero prevenire almeno un terzo di tutti i casi di tumore. Le azioni di prevenzione corrispondono a: una regolare attività fisica, non avere abitudini dannose (alcolici e fumo) e mantenere una corretta alimentazione.
E’ oramai comprovato da tantissime pubblicazioni che le molecole contenute negli alimenti hanno effetti protettivi dalle malattie oncologiche e la ricerche suggeriscono che in tale prevenzione il microbiota intestinale (i batteri che vivono nel nostro intestino) giochi un ruolo fondamentale.
Infatti, sebbene gli studi tra il legame tra microbiota e cancro siano iniziati da pochi anni, i ricercatori stanno osservando come i batteri intestinali siano in grado di influenzare il sistema immunitario per mezzo della produzione di molecole che modulano la condizione infiammatoria, non solo nel tratto intestinale, ma anche in altre parti del corpo come ad esempio nella mammella (Figura 1).
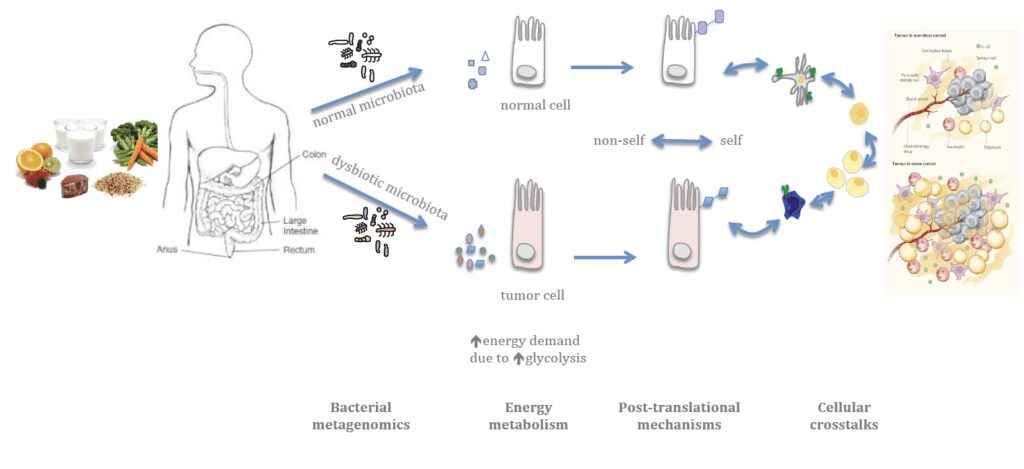
Figura 1 – Microbiota e la prevenzione al tumore al seno
Correlazioni tra il microbiota del tessuto mammario e lo stato oncologico
A maggio di quest’anno è stata pubblicata una ricerca nella quale è stato evidenziato come il carcinoma mammario positivo ai recettori ormonali HR+ (la forma più diffusa di cancro al seno), a causa della flora batterica intestinale alterata (disbiosi), possa diventare più aggressivo ed invasivo accelerando la diffusione metastatica già nelle prime fasi della malattia.
Uno studio condotto da un gruppo di ricerca statunitense della Cleveland Clinic, in Ohio (USA), pubblicato recentemente sulla rivista Oncotarget, ha evidenziato che il microbiota del tessuto mammario in pazienti con tumore del seno è significativamente diverso da quello di donne sane. Nello specifico, i risultati di questo studio notavano, nelle donne con tumore al seno, un deciso incremento de genere Methylobacterium (Figura 2 e 3).
Questo studio è un ulteriore progresso nel cercare di capire la complessità dei fenomeni interessati allo sviluppo della patologia oncologica del tessuto mammario. Le ricerche stanno sempre più evidenziando anche l’importanza e il ruolo del microbiota mammario e come quest’ultimo si modifichi nelle donne con tumore al seno rispetto a quello di donne sane.
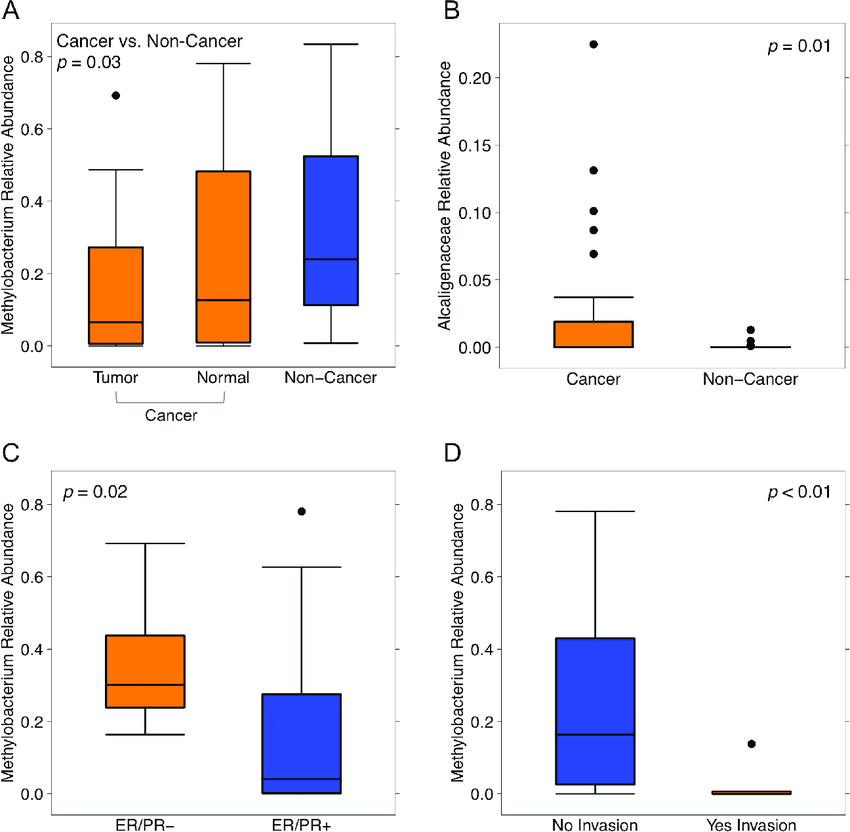

Tale incremento dell’aggressività delle cellule tumorali avviene perché la disbiosi intestinale determina un’infiammazione sistemica che si genera anche all’interno del tessuto mammario: in quest’ambiente infiammato, le cellule tumorali aumentano la loro capacità infiltrativa, quindi l’aggressività, aumentando in questo modo la capacità di diffondersi dal tessuto mammario al sangue e nei polmoni.
I polmoni, infatti, rappresentano uno dei siti principali in cui il carcinoma mammario positivo ai recettori ormonali tende a sviluppare metastasi e a proliferare (Figura 4).

Figura 4 – Diffusione del tumore dal tessuto mammario ai polmoni
Questa ricerca del 2017, anche se presenta alcune limitazioni dovute al numero ristretto e non omogeneo di soggetti arruolati, apriva il sospetto che il microbiota mammario potesse avere un ruolo nella patologia oncologica.
Da qui, si correla uno studio pubblicato nel 2018 su Cell Reports e condotto da Carol A. Shively e i colleghi della Wake Forest School of Medicine, ha permesso di comprendere come il cibo influisca sulla composizione del microbiota mammario permettendo o meno lo sviluppo o meno di specie batteriche ad azione infiammatoria.
Lo studio ha confrontato, infatti, il microbiota prelevato da ghiandole mammarie di 40 femmine di primati (Macaca fascicularis) con tumore al seno, le quali sono state alimentate per 31 giorni rispettivamente con dieta mediterranea e occidentale (Figura 5).
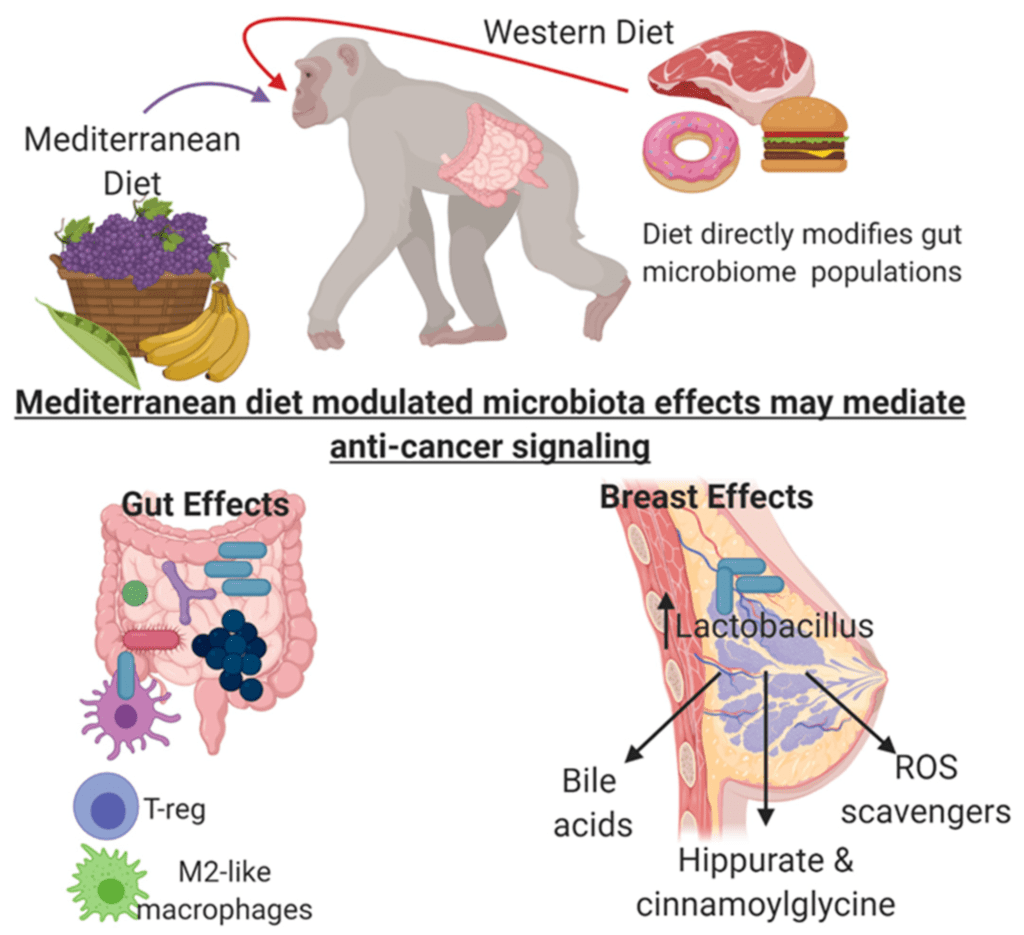
Figura 5 – Cambio del microbiota mammario con dieta mediterranea e occidentale
I risultati hanno osservato notevoli differenze nella popolazione del microbiota mammario a seconda del tipo di dieta effettuata.
Durante l’alimentazione con la dieta mediterranea si è notato un notevole incremento di espressione a livello mammario (pari a 10 volte all’alimentazione con la dieta occidentale), del phylum Fusobacteria e del genere Lactobacillus mentre si è osservata la diminuzione di Ruminococcaceae e Lachospiraceae.
La dieta occidentale (ricca in grassi) ha invece portato all’aumento delle specie batteriche ad azione più infiammatoria: Ruminococcus, Lachnospiraceae, Oscillospira e Coprococcus.
Studiando poi i metaboliti prodotti dai batteri si è dimostrato che, durante l’alimentazione con la dieta mediterranea, si sono visti calare i metaboliti pro-infiammatori (Figura 6).

Figura 6 – Calo dei metaboliti pro-infiammatori durante la dieta mediterranea
In conclusione, dunque, la dieta modula non solo la popolazione batterica intestinale, ma anche quella di altri siti anatomici, compresa la ghiandola mammaria e questo può rappresentare una possibile via di intervento alternativa per la prevenzione del cancro al seno, da indagare con ulteriori e approfonditi studi.
Prevenite il tumore alla mammella cambiando il microbiota con l’alimentazione
Negli individui sani la composizione del microbiota intestinale è estremamente diversificata, con i ceppi batterici protettivi in quantità superiore rispetto a quelli potenzialmente dannosi. Se invece al contrario, i ceppi patogeni prevalgono sui ceppi protettivi, si ha un incremento dell’infiammazione e questo può influenzare la stabilità genomica delle cellule dell’organismo, giocando un ruolo importante nella progressione tumorale.
La dieta pertanto, ha un peso rilevante nel determinare la composizione del microbiota e quindi la possibilità di modulare i processi infiammatori e di prevenzione.
Studi sperimentali e clinici dimostrano che il tipo e la qualità di cibo che mangiamo influenza velocemente e drasticamente il microbiota. Questi microrganismi hanno un ruolo importante: sia nell’aiutarci a completare l’assorbimento dei cibi che consumiamo giornalmente, sia per produrre, per mezzo della digestione microbica, dei metaboliti che svolgono un ruolo chiave nel regolare il metabolismo, i livelli d’infiammazione e quindi la nostra salute (Figura 7).
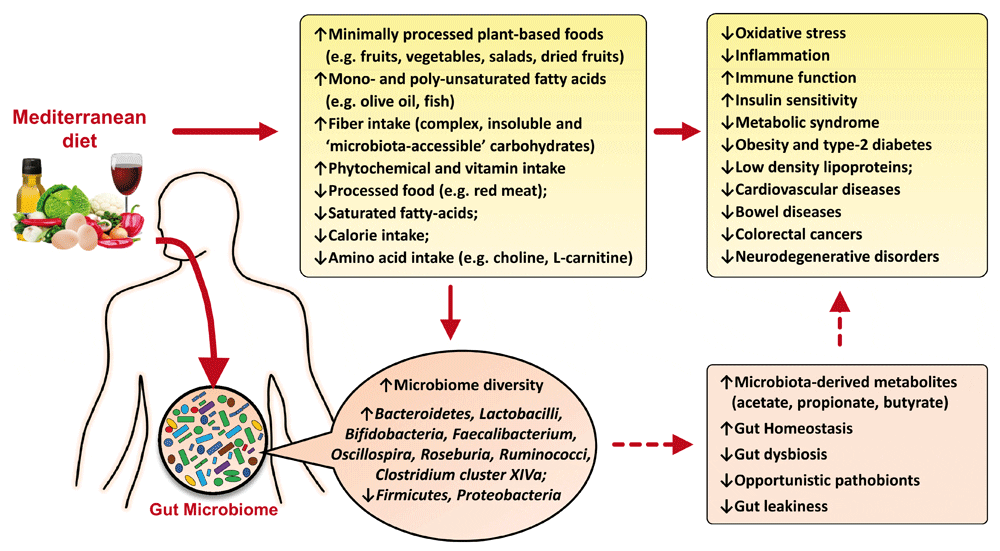
Figura 7 – Cibo e microbiota
Pertanto, un microbiota alterato abbinato a una dieta sbilanciata (ricca in grassi, carne rossa, prodotti processati), può promuovere dei processi infiammatori che possono portare alla progressione tumorale.
E’ quindi importante, per far funzionare al meglio il microbiota intestinale, diversificare la nostra dieta, consumando settimanalmente una vasta gamma e varietà di frutta e verdura (ricche di fibre e fonti di vitamine e sali minerali), rispettando anche la stagionalità, cereali integrali (anch’essi ricchi di fibre), legumi, olio d’oliva, pesce preferibilmente azzurro, frutta secca (mandorle, noci), yogurt naturale (non cremoso), kefir (nel quale sono presenti batteri che conferiscono benefici alla salute) e riducendo il consumo di insaccati (salumi, prosciutti e wurstel), carni rosse (ovine, suine, bovine), prodotti in scatola, alcol e lo zucchero, che è contenuto in quasi tutto quello che mangiamo.
Come l’alimentazione cambia i metaboliti batterici
Come descritto in precedenza, il microbiota durante le sue azioni biologiche di fermentazione batterica, produce delle molecole (metaboliti) la cui tipologia viene influenzata dalla diversità e composizione dalla dieta, vediamo quali sono i loro effetti:
Metaboliti batterici ad azione antitumorale
SCFA – Acidi grassi a corta catena (acetato, butirrato, propionato)
- Tali metaboliti sono i principali prodotti della fermentazione batterica di carboidrati e proteine nell’intestino (ileo terminale e colon) per mezzo delle seguenti specie batteriche: Bacteroides, Bifidobacterium, Propionibacterium, Eubacterium, Lactobacillus, Clostridium, Roseburia e Prevotella.
- Gli alimenti che permettono a tali batteri di produrre SCFA sono la fibra alimentare solubile o oligosaccardidi (frutta, verdura, legumi) oppure possono essere già presenti nel latte caprino o nei prodotti fermentati come: yogurt, yogurt greco, kefir, miso, tempeh, aceto, verdure lattofermentate sott’aceto, the komucha, carboidrati con lievito madre.
- Gli SCFA sono presenti in molte cellule, soprattutto nelle cellule assorbenti intestinali, dove vengono utilizzate come substrato per produrre energia. Agiscono anche come molecole di segnalazione intracellulare e extracellulare, attivando le vie che regolano il metabolismo lipidico e glucidico. Inoltre, possono avere un impatto anche sul processo di trascrizione, inibendo gli enzimi epigenetici. Infine, hanno un ruolo importante nella regolazione della risposta immunitaria e dell’infiammazione.
In condizioni di disbiosi, il numero di specie batteriche che producono SCFA può notevolmente diminuire. Si pensa che gli SCFA abbiano diversi effetti antitumorali, derivanti dalla stimolazione della risposta immunitaria. Inoltre, a causa del metabolismo alterato, le cellule neoplastiche non possono utilizzare facilmente gli SCFA come fonte di energia; di conseguenza, si accumulano nel citoplasma e sensibilizzano le cellule del colon verso l’apoptosi (Figura 8).

Figura 8 – Alimenti che permettono a tali batteri di produrre SCFA
Metaboliti batterici ad azione tumorale
SBA – Acidi biliari secondari
- Gli SBA, soprattutto acido desossicolico e litocolico, vengono prodotti dal microbiota a partire dagli acidi biliari primari prodotti nel fegato e secreti per mezzo dalla cistifellea a livello intestinale per permettere la digestione dei grassi.
- Gli alimenti che stimolano i batteri a produrre SBA sono cibi grassi e processati (insaccati, carni processate, fritti, burro, formaggi).
- Contrariamente agli SCFA, si ritiene che gli SBA siano in grado di promuovere la carcinogenesi, dal momento che sono coinvolti nel danno del DNA a causa della loro capacità di produrre radicali liberi dell’ossigeno e specie reattive dell’azoto.
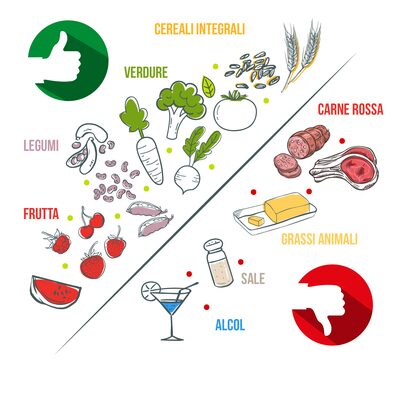
Figura 9 – Associazione tra dieta e cancro relativamente ad alcuni alimenti
In Conclusione:
Elevati livelli di SBA e ridotti livelli di SCFA potrebbero spiegare l’associazione tra diete ad alto contenuto di grassi e aumento del rischio di carcinoma e tra diete ad alto contenuto di fibre e riduzione del rischio di cancro (Figura 9)
Bibliografia
- Muegge et al., Science 2011 Diet drives convergence in gut microbiome functions across mammalian phylogeny and within humans.
- Rampelli S et al., Curr Biol 2015 Metagenome Sequencing of the Hadza Hunter-Gatherer Gut Microbiota.
- Clemente JC et al., Cell 2012 The impact of the gut microbiota on human health: an integrative view.
- Thorburn AN et al., Immunity 2014 Diet, metabolites, and “western-lifestyle” inflammatory diseases.
- Charis Eng et al., Oncotarget. 2017 Breast tissue, oral and urinary microbiomes in breast cancer
- Carol A. Shively Thomas C. et al. Cell Oct 02, 2018 Consumption of Mediterranean versus Western Diet Leads to Distinct Mammary Gland Microbiome Populations
- R Rutkowski et al. Cancer May 7, 2019 Preexisting Commensal Dysbiosis Is a Host-Intrinsic Regulator of Tissue Inflammation and Tumor Cell Dissemination in Hormone Receptor-Positive Breast Cancer.
Emanuele Rondina – Biologo Nutrizionista