La bioluminescenza
Il primo principio della termodinamica indica che l’energia di un sistema può essere convertita da una forma ad un’altra, ma non può essere né creata e né distrutta. Cioè, l’energia perduta da un sistema può essere guadagnata da un altro sistema in forma diversa. Basti pensare che l’energia perduta bruciando combustibile in un impianto si ritrova nelle case sotto forma di energia elettrica, luce, calore. Ebbene, alcuni organismi animali e vegetali (insetti, cefalopodi, pesci, cnidari, alghe) sono capaci di convertire l’energia chimica in energia luminosa mediante il fenomeno della bioluminescenza.
Si pensi alle lucciole che illuminano le notti d’estate e che, inconsapevoli – o consapevoli, chissà! – ci rendono testimoni di un fenomeno senza eguali. Dal punto di vista chimico – fisico, nella bioluminescenza alcune molecole (luciferine), prodotte in uno stato elettronico eccitato, tornando allo stato fondamentale, perdono parte dell’energia e la riemettono sotto forma di radiazione luminosa. E anche alcuni batteri possono fornire luce!
Luci microscopiche
Vibrio fischeri è un batterio bioluminescente Gram negativo che vive in ambienti marini instaurando un rapporto simbiotico con il cefalopode Euprymna scopoles (Fig. 1 a e b), occupando di quest’ultimo un organo luminoso (fotoforo). In questa associazione, il calamaro fornisce aminoacidi e zuccheri per la sopravvivenza del batterio; da parte sua il batterio, emettendo la stessa quantità di luce che colpisce la parte superiore del mantello del calamaro, ne nasconde la sagoma quando è visto da sotto (fenomeno della controilluminazione) e, dunque, ne permette il camuffamento e il non riconoscimento da parte di possibili predatori.


Genetica e meccanismi biochimici della bioluminescenza in Vibrio fischeri
Il batterio V. fischeri possiede due cromosomi e, nell’isolato ES114, oggetto degli studi descritti in questo articolo, è presente anche un plasmide. I geni responsabili della formazione dei componenti strutturali e funzionali necessari per la produzione della luce si trovano sul cromosoma II e sono raggruppati nell’operone luxCDABEG (Fig. 2) e regolati dal sistema di quorum sensing LuxR – LuxI, codificato dai geni luxR e luxI.
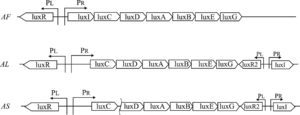
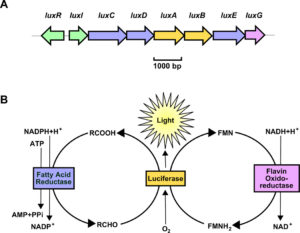
I geni luxA e luxB dell’operone lux codificano rispettivamente per la catena alfa e per la catena beta dell’enzima luciferasi (Fig.3). Quest’ultimo libera energia luminosa durante l’ossidazione accoppiata di un’aldeide a catena lunga e del flavin mononucleotide ridotto (FMNH2). L’aldeide presente nella reazione di ossidazione è il prodotto dell’attività di tre enzimi: l’enzima acil – transferasi, codificato dal gene luxD, che recupera gli acidi grassi dal pathway di biosintesi trasferendoli al pathway della bioluminescenza; l’enzima acil – reduttasi, codificato dal gene luxC, che riduce un acido grasso ad aldeide. Infine, l’enzima ligasi, codificato in V. fischeri dal gene luxE, permette la formazione dell’aldeide a catena lunga. Il flavin mononucleotide ridotto è fornito dal gene luxG.
La regolazione dell’espressione dell’operone lux
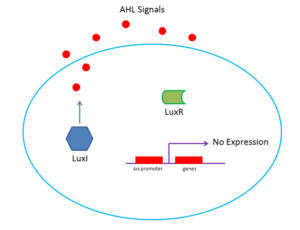
L’espressione dell’operone lux è regolata dall’attività del fattore di trascrizione LuxR, codificato dal gene luxR, attivato, a sua volta, dall’autoinduttore N – 3 ossoesanoil omoserina lattone (HSL), codificato dal gene luxI. I geni luxR e luxI si trovano sul cromosoma II di V. fischeri (Fig. 4 a e b).
L’HSL e il fattore di trascrizione LuxR sono i componenti del sistema di regolazione di quorum sensing, un sistema di regolazione a due componenti – molecola segnale e attivatore trascrizionale – che dipende dalla densità cellulare. La molecola segnale, che nel caso di V. fischeri è l’HSL, diffonde rapidamente attraverso la membrana cellulare batterica ed entra nel citoplasma delle cellule batteriche adiacenti. Questa diffusione dell’HSL attraverso la membrana permette al batterio di determinare la quantità di cellule batteriche. Un’alta concentrazione della molecola segnale indica un elevato numero di cellule batteriche.
Dunque, quando la concentrazione della molecola segnale raggiunge un valore soglia (è stato stimato che sono sufficienti 120 nM di HSL per indurre luminescenza in V. fischeri), l’HSL può legare ed attivare il fattore di trascrizione LuxR che induce l’espressione dell’operone luxCDABEG e quindi la sintesi della luciferasi e degli enzimi che prendono parte alla formazione dei substrati della reazione che la luciferasi catalizza.

Il complesso LuxR/HSL lega una sequenza di DNA di 20 coppie di base (bp) presente nella regione intergenica luxR – luxI chiamata “lux box”.
È ormai noto che Vibrio fischeri possiede almeno altri due meccanismi di regolazione di quorum sensing per la bioluminescenza, i quali si basano sulla presenza degli autoinduttori N– ottanoil – omoserina lattone, sintetizzata da AinS e legante AinR e LuxR e autoinduttore – 2, sintetizzato da LuxS e legante LuxP.
Gli studi genomici
Le caratteristiche di Vibrio fischeri osservate nella comunicazione cellulare, nella regolazione dell’espressione genica e nella simbiosi con Euprymna scolopes hanno ispirato, a partire dallo primo decennio del Duemila, numerosi studi di sequenziamento genico.
Nel 2005 su PNAS (Proceedings of the National Academy of Sciences) è stato pubblicato uno studio di sequenziamento del genoma di Vibrio fischeri effettuato da un gruppo di ricercatori americani. Oggetto di studio è stato il ceppo di Vibrio fischeri ES114, contenente due cromosomi (cromosoma I: 2,9 Mbp; cromosoma II: 1,3 Mbp) ed un plasmide la cui espressione produrrebbe un sistema di secrezione di tipo IV.
Sono stati analizzati il contenuto in G+C (38,3%) e la distribuzione degli operone degli RNA ribosomiali (11 operoni sul cromosoma I e 1 sul cromosoma II). È stata evidenziata, inoltre, la presenza di elementi mobili e di un cluster genico codificante il fattore di virulenza TCP. Infatti, nonostante Vibrio fischeri sia ritenuto non patogeno e la sua variante ES114 stabilisca un rapporto addirittura simbiotico con gli organismi marini, nel suo genoma sono presenti geni omologi a quelli del batterio patogeno appartenente alla sua stessa famiglia, Vibrio cholerae. Il motivo della presenza di fattori di patogenicità deve essere chiarito e, in questa direzione, sono in corso numerosi studi.
Concludendo, la comprensione dei meccanismi biochimici e molecolari del fenomeno della bioluminescenza – fenotipicamente importante – ha permesso di approfondire gli aspetti genetici di uno straordinario batterio quale il Vibrio fischeri. La sua utilità nell’ambito degli studi genetici e di biologia molecolare deve essere ulteriormente approfondita per chiarire la sua eventuale partecipazione ad altri rilevanti fenomeni molecolari.
Maria Chiara Langella
Fonti
- Shedding light on bioluminescence regulation in Vibrio fischeri di Tim Miyashiro and Edward G. Ruby. Mol Microbiol. 2012 June.
- Complete genome sequence of Vibrio fischeri: A symbiotic bacterium with pathogenic congeners di E. G. Ruby, M. Urbanowski, J. Campbell, A. Dunn, M. Faini, R. Gunsalus, P. Lostroh, C. Lupp, J. McCann, D. Millikan, A. Schaefer, E. Stabb, A. Stevens, K. Visick, C. Whistler and E. P. Greenberg. PNAS February 22, 2005.
Immagini
- http://feedthedatamonster.com/home/2013/9/11/mutualism-of-the-month-hawaiian-bobtail-squid
- https://www.uniprot.org/taxonomy/6613
- http://jb.asm.org/content/193/15/3998/F1.expansion.html
- da Shedding light on bioluminescence regulation in Vibrio fischeri di Tim Miyashiro and Edward G. Ruby. Mol Microbiol. 2012 June.
- https://openwetware.org/wiki/CH391L/S13/QuorumSensing