Il ruolo del linfociti T nella terapia contro il cancro
Numerose ricerche dimostrano che il microbiota intestinale gioca un ruolo da protagonista nella terapia contro il cancro, soprattutto in quelle terapie che coinvolgono il sistema immunitario. Tra le cellule immunitarie, i linfociti T sono quelle che contribuiscono maggiormente alla regressione del tumore. Infatti, riconoscono le cellule tumorali dalle proteine esposte sulla loro superficie (diverse da quelle esposte sulle cellule sane) e rilasciano enzimi che le distruggono. La presenza di questi linfociti nei tessuti tumorali è correlata con una buona prognosi ed esistono protocolli terapeutici che prevedono l’espansione in vitro e il trasferimento adottivo nel paziente dei linfociti T isolati dal tumore o dal sangue periferico (Fig. 1).
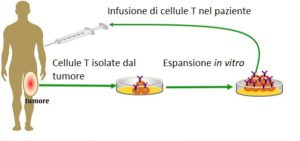
Nonostante i risultati promettenti ottenuti in fase di sperimentazione clinica, in una percentuale dei pazienti il trattamento non ha riscosso il successo sperato. Le ragioni potrebbero essere varie, come la capacità del tumore di sfuggire al controllo del sistema immunitario. Sorge però spontaneo chiedersi se esistano fattori, ancora sconosciuti, in grado di regolare l’attività dei linfociti T e quindi la risposta immunitaria contro il tumore.
Un possibile candidato è proprio il microbiota intestinale, la cui azione su fenotipo e funzione delle cellule T è sostenuta da numerosi articoli scientifici. Di recente, un gruppo di ricercatori dell’Università della Pennsylvania ha pubblicato uno studio che chiarisce il ruolo del microbiota nella terapia cellulare adottiva a base di linfociti T nei topi con cancro alla cervice e al polmone.
Lo studio
Nello studio vengono utilizzati due gruppi di topi dello stesso ceppo, ma acquistati da stabulari diversi. In questo modo, benché i topi impiegati negli esperimenti possiedano lo stesso background genetico, il microbiota intestinale varia a seconda delle condizioni ambientali e di stabulazione. Si è osservato che i due gruppi di topi, che chiameremo A e B, rispondono diversamente alla terapia con linfociti T. In particolare, A risponde più di B. I ricercatori hanno dunque sequenziato il DNA estratto dalle feci di entrambi i gruppi per determinare la composizione del microbiota intestinale, che varia sostanzialmente tra i due. In particolare la famiglia Bacteroidales, del phylum dei Bacteroidetes, è predominante nei topi B.
Gli effetti del trattamento con antibiotici
Per comprendere come questa diversa composizione della comunità microbica intestinale regoli la risposta alla terapia a base di cellule T, i topi dei gruppi A e B sono stati sottoposti a trattamento con un antibiotico, la vancomicina. Questa ha ridotto significativamente il numero dei taxa batterici nell’intestino, in particolare quelli Gram-positivi, ma anche quelli Gram-negativi del phylum dei Bacteroidetes. Curiosamente, nei topi B trattati con vancomicina, il trasferimento adottivo di linfociti T si è rivelato più efficace. Ha infatti ridotto significativamente la crescita tumorale in maniera paragonabile a quanto osservato nei topi A (che si comportano invece allo stesso modo sia con che senza vancomicina).
Dall’analisi del DNA isolato dalle feci si è potuto osservare quali batteri variano maggiormente col trattamento antibiotico e in relazione alla progressione del tumore, e appartengono tutti all’ordine Clostridiales o alla famiglia Bacteroidales. Infatti, la co-somministrazione di linfociti T e antibiotici diversi dalla vancomicina, che hanno come bersagli popolazioni microbiche diverse, non produce cambiamenti sulla crescita tumorale.

Quindi, riassumendo, esistono nel microbiota intestinale di questi animali una o più popolazioni batteriche sensibili alla vancomicina che “si oppongono” alla terapia cellulare adottiva a base di linfociti T. Eliminandole, l’efficacia del trattamento aumenta, con significativa riduzione della crescita tumorale.
Il ruolo delle cellule dendritiche
Gli scienziati hanno fatto qualcosa di più, chiarendo quali siano le popolazioni cellulari e i mediatori interessati. Hanno dunque scoperto che la somministrazione di vancomicina aumenta una sub-popolazione di cellule dendritiche, ovvero le componenti immunitarie che danno inizio alla risposta contro l’antigene, e producono l’interleuchina-12 (IL-12), un mediatore chimico essenziale per la differenziazione, proliferazione e mantenimento delle cellule T. Non a caso IL-12 è risultata aumentata nei pazienti sottoposti a trattamento con vancomicina.
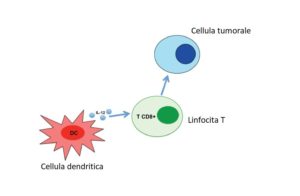
Conclusioni: qual è l’effetto del microbiota sulla terapia del cancro?
Microbiota intestinale e sistema immunitario sono quindi alleati o nemici nella lotta contro il cancro? Dopo la lettura di questo articolo potremmo propendere per la seconda ipotesi. In realtà questo è solo uno degli studi che associano l’immunoterapia del cancro alle variazioni del microbiota, ma ce ne sono numerosi altri…molti dei quali suggeriscono una correlazione “positiva” tra ricchezza e diversità delle specie microbiche risiedenti nell’intestino e buon esito della terapia!
Questo campo di ricerca è estremamente complesso e non esiste una risposta unica. Infatti, il microbiota conta decine di trilioni di microorganismi, per un totale di 500-1000 specie conosciute. E’ quindi facile immaginare come in questo “caos” coesistano specie “buone” in grado di agire in sinergia con il sistema immunitario e contrastare la crescita tumorale, e specie meno buone, che interferiscono con le terapie immunologiche, sostenendo la progressione del tumore. E ancora, il microbiota intestinale è di per sé associato ai più disparati stati fisiologici e patologici e dunque qualsiasi trattamento che ne modifichi la composizione va studiato attentamente, pesando tutte le possibili conseguenze.
Erika Salvatori