Microbiota intestinale e patologie cardiovascolari
Seguire un’alimentazione corretta e mantenere uno stile di vita sano sono di certo le prime azioni da attuare per mantenere i valori di colesterolemia nella norma e di conseguenza attuare un’importante prevenzione alle patologie cardio e cerebrovascolari.
Però oltre che attraverso l’alimentazione e lo stile di vita, si sta comprendendo sempre di più come anche il microbiota intestinale abbia un importante ruolo del nell’influenzare la concentrazione di colesterolo ematico predisponendoci o meno alle patologie cardiovascolari.
In particolare, l’attività dei batteri del microbiota intestinale, nell’influenzare le patologie cardiovascolari passa attraverso i seguenti meccanismi principali:
- assimilazione del colesterolo all’interno della cellula batterica;
- produzione di TMAO a partire da carnitina e colina;
- degradazione del colesterolo degli acidi biliari mediante la trasformazione in coprostanolo.
L’assimilazione del colesterolo nella cellula batterica
Questo meccanismo consiste nell’incorporazione del colesterolo e dei lipidi presenti nel lume intestinale all’interno del batterio, facendo diminuire in questo modo, il quantitativo totale disponibile all’assorbimento da parte degli enterociti (le cellule intestinali dove avviene l’assorbimento delle molecole del cibo).
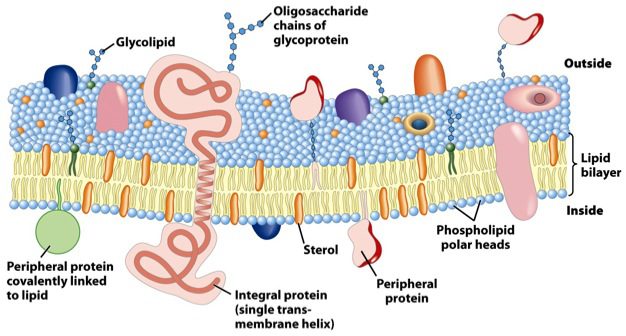
Il colesterolo, essendo inserito come molecola chiave nella parete batterica, esercita un ruolo cruciale per la sopravvivenza dei microorganismi, interagendo con i fosfolipidi di membrana, modulandone la fluidità (Figura 1). Questa interazione, cambia il rapporto fra acidi grassi di membrana saturi e insaturi, aumentando la resistenza cellulare alla lisi, e quindi la sopravvivenza del batterio. Questa capacità è tipica di vari Bifidobatteri come B. bifidum, B. breve, B. animalis, i quali, in presenza di colesterolo, aumentano la trascrizione di geni responsabili della sintesi di trasportatori di membrana ATP dipendenti, che favoriscono l’entrata di molecole a nucleo steroideo all’interno del batterio facendo diminuire il colesterolo assorbito a livello intestinale e di conseguenza livelli di colesterolo nel sangue.
La produzione di TMAO a partire da carnitina e colina
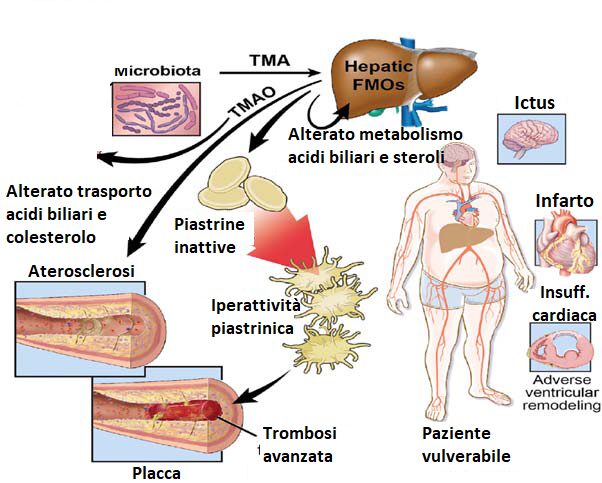
Un’altro fattore di influenza del microbiota intestinale sul rischio aterosclerotico, è la capacità di alcuni batteri presenti nel lume intestinale (come gli Acinetobacter), di trasformare le molecole L-carnitina e colina in trimetilammina N-ossido (TMAO).
Le molecole di TMAO che derivano dai batteri intestinali a partire dalla colina o dalla carnitina (assunte attraverso l’alimentazione), favoriscono:
- l’accumulo di colesterolo nei macrofagi e accumulo di cellule schiumose nelle pareti delle arterie;
- un alterato signaling del calcio che provoca iperattività piastrinica e fenotipo protrombotico in vivo.
Questo genera un notevole incremento di eventi cardiovascolari (infarto e ictus).
Alti livelli di TMAO nel sangue sono associati ad un aumentato rischio di eventi avversi cardiovascolari (MACE), come morte da infarto del miocardio o ictus, a riprova di ciò, una meta-analisi del 2017 ha rilevato che un TMAO circolante più alto era associato a un aumento del rischio cardiovascolare del 23% e il rischio che tale evento porti alla morte della persona è del 55% più alto (Figura 2).
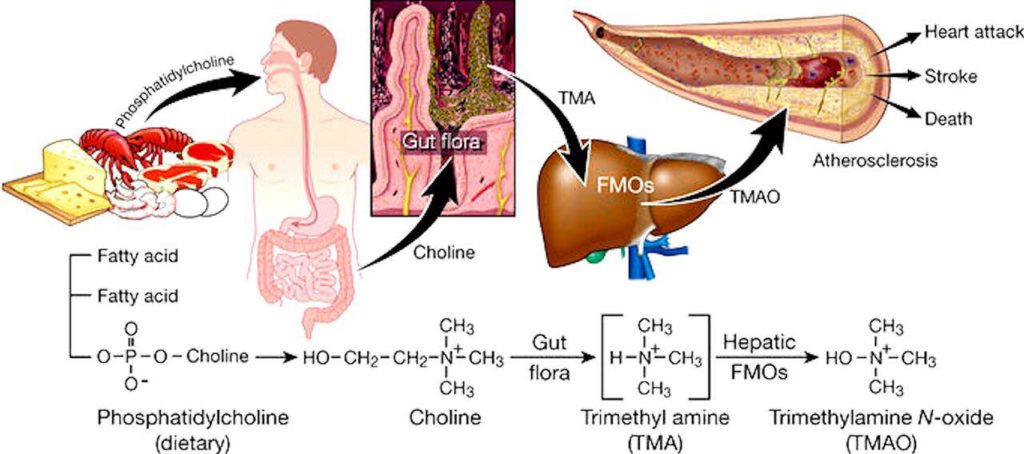
Pero’ dagli ultimi studi, sembra che esista una concentrazione soglia di colina che debba essere assunta per poter dare origine a TMAO, questo perchè la colina è assorbita dall’intestino tenue tramite un trasportatore saturabile alla concentrazione di colina nell’intestino di 200-300 mM.
Quindi solo quando questa concentrazione viene superata con la dieta (ricca in carni rosse o alimenti ricchi di lecitina), l’eccesso di colina raggiunge l’intestino crasso e viene metabolizzata dai batteri intestinali a formare trimetilammina (TMA), queste molecole sono assorbite nella circolazione sanguigna e raggiungono il fegato, qui vengono rapidamente ossidate a TMAO ad opera di un enzima epatico, la monoossigenasi contenente flavina (FMO, flavincontaining monooxygenase) per poi passare al flusso ematico e generando i proplemi vascolari descritti (Figura 3).
La metabolizzazione enzimatica degli acidi biliari
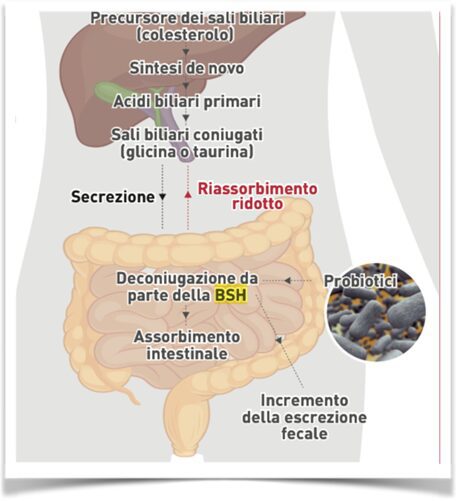
Il microbiota intestinale esplica un ruolo rilevante anche nella composizione della bile, in particolare, alcuni batteri promuovono la deconiugazione degli acidi biliari, vale a dire la rimozione di glicina e taurina e questo impedisce il riassorbimento della bile nell’intestino tenue da parte del trasportatore ASBT.
Questa reazione dipende interamente dall’attività dei batteri intestinali dotati dell’enzima idrolasi degli acidi biliari (BSH, Bile salt hydrolase). Tale enzima è espresso in moltissimi batteri che popolano il tratto digerente dell’uomo, in particolare in Lactobacilli e Bifidobacteria, e garantisce loro una maggiore resistenza alla tossicità dovuta agli acidi biliari.
Per capire la correlazione tra il mancato assorbimento della bile e l’abbassamento del colesterolo ematico, è importante sapere che l’uomo assume con la dieta circa 400 mg/die di colesterolo, ma solo il 50% viene assorbito nell’intestino tenue.
La quota di colesterolo dietetico non assorbita, sommata al colesterolo in arrivo con la bile, a quello derivante dal continuo ricambio degli enterociti e a quello escreto direttamente nel lume intestinale mediante la cosiddetta Trans-Intestinal Cholesterol Excretion (TICE), determina un contenuto di circa 1 g/die di colesterolo nelle feci.
Il colesterolo che giunge nell’intestino viene metabolizzato dai batteri presenti nel lume: questi riducono il colesterolo a coprostanolo e, in minima quantità, a coprostanone. Il coprostanolo, essendo scarsamente assorbibile da parte degli enterociti, favorisce l’eliminazione del colesterolo dall’organismo e conseguentemente contribuisce a ridurre i livelli plasmatici di colesterolo (Figura 4).
Conclusioni
In conclusione, si può dunque affermare che i fattori che influenzano i livelli ematici di colesterolo sono molteplici, tra questi oltre alla dieta, si sta sempre più comprendendo il ruolo importante del microbiota intestinale nella patogenesi dei disordini cardiovascolari.
Al momento ciò che sappiamo a riguardo è ancora limitato e saranno necessari studi clinici su un numero più ampio di pazienti per avere evidenze clinicamente utilizzabili. Sarà così possibile conoscere a fondo la relazione esistente tra popolazioni batteriche e rischio di sviluppare malattie cardiovascolari.
Chissà, se in futuro, per trattare le dislipidemie non avremo solo le statine, ma inizieremo a pensare anche al microbiota intestinale come target di terapia.
Emanuele Rondina – Biologo Nutrizionista
Bibliografia
- Piemontese A, Bernini F, Zanotti I. Microbi- ota intestinale: un nuovo protagonista nella eziologia e nel trattamento dell’aterosclerosi? Giornale Italiano dell’Arteriosclerosi. 2016; 7: 64-83.
- Bordoni A, Amaretti A, Leonardi A, et al. Chole- sterol-lowering probiotics: In vitro selection and in vivo testing of bifidobacteria. Appl Microbiol Biotechnol 97(18):8273-8281, 2013
- Mente A, Chalcraft K, Ak H, et al. The Rela- tionship Between Trimethylamine-N-Oxide and 2013
- Zeisel SH, daCosta K a, Youssef M, et al. Con- version of dietary choline to trimethylamine and dimethylamine in rats: dose-response rela- tionship. J Nutr 119(5):800-804, 1989
- Gérard P. Metabolism of cholesterol and bile ac- ids by the gut microbiota. Pathogens. 2013; 3: 14-24.
- Jones BV, Begley M, Hill C, et al. Functional and comparative metagenomic analysis of bile salt hydrolase activity in the human gut microbiome. Proc Natl Acad Sci USA. 2008; 105: 13580-5.
- Wang Z, Klipfell E, Bennett BJ, et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature 472(7341):57-63, 2009 2011
- Veiga P, Juste C, Lepercq P, et al. Correlation between faecal microbial community structure and cholesterol-to-coprostanol conversion in the human gut. FEMS Microbiol Lett. 2005; 242: 81-6.
- W.H. Wilson Tang, Zeneng Wang e Bruce S. Levison, Intestinal Microbial Metabolism of Phosphatidylcholine and Cardiovascular Risk, in New England Journal of Medicine, vol. 368, nº 17, 25 aprile 2013, pp. 1575–1584, DOI:10.1056/nejmoa1109400.
- Robert A Koeth, Zeneng Wang e Bruce S Levison, Intestinal microbiota metabolism of l-carnitine, a nutrient in red meat, promotes atherosclerosis, in Nature Medicine, vol. 19, nº 5, 7 aprile 2013, pp. 576–585, DOI:10.1038/nm.3145. URL consultato il 24 aprile 2018.
- W.H. Wilson Tang, Zeneng Wang e Bruce S. Levison, Intestinal Microbial Metabolism of Phosphatidylcholine and Cardiovascular Risk, in New England Journal of Medicine, vol. 368, nº 17, 25 aprile 2013, pp. 1575–1584, DOI:10.1056/nejmoa1109400.
- Gina Kolata, Eggs, Too, May Provoke Bacteria to Raise Heart Risk, in The New York Times, 24 aprile 2013. URL consultato il 24 aprile 2018.
- New Research On Red Meat And Heart Disease – Diane Rehm, in Diane Rehm
- Heidi L. Collins, Denise Drazul-Schrader e Anthony C. Sulpizio, L-Carnitine intake and high trimethylamine N-oxide plasma levels correlate with low aortic lesions in ApoE−/− transgenic mice expressing CETP, in Atherosclerosis, vol. 244, 2016-01, pp. 29–37, DOI:10.1016/j.atherosclerosis.2015.10.108
- A.M. Johri, D.K. Heyland e M.-F. Hétu, Carnitine therapy for the treatment of metabolic syndrome and cardiovascular disease: Evidence and controversies, in Nutrition, Metabolism and Cardiovascular Diseases, vol. 24, nº 8, 2014-08, pp. 808–814, DOI:10.1016/j.numecd.2014.03.007
- Marcin Ufnal, Radoslaw Jazwiec e Michal Dadlez, Trimethylamine-N-Oxide: A Carnitine-Derived Metabolite That Prolongs the Hypertensive Effect of Angiotensin II in Rats, in Canadian Journal of Cardiology, vol. 30, nº 12, 2014-12, pp. 1700–1705, DOI:10.1016/j.cjca.2014.09.010..
- A. Piemontesi et al.Giornale Italiano dell’arteriosclerosi 2016
- Martinez I et al, Appl Environ Microbiol 2009
- Tang WH et al, N Engl J Med 2013