Caratteristiche
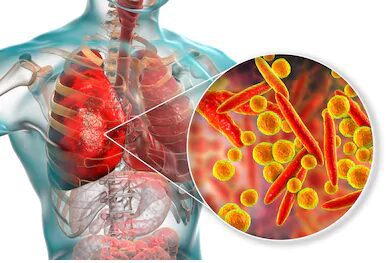
Mycoplasma pneumoniae è un microrganismo patogeno per l’uomo, causa infezioni del tratto respiratorio superiore ed è il principale agente eziologico delle cosiddette Community-Acquired Pneumonia (CAP) o polmoniti “atipiche” acquisite in comunità che colpiscono principalmente i bambini.
L’infezione da M. pneumoniae (Figura 1) può essere causa di malattie polmonari croniche, asma bronchiale o comportare danni permanenti all’apparato respiratorio, soprattutto nella popolazione più vulnerabile.
M. pneumoniae appertiene alla categoria dei micoplasmi, ovvero dei microorganismi inusuali: sono classificati come batteri ma sono privi della parete cellulare.
In merito alla sua scoperta, questo microorganismo venne identificato per la prima volta nel 1944 e denominato agente di Eaton (dal nome del ricercatore autore della scoperta). Date le piccole dimensioni cellulari (1-2 μm x 0.1-0.2 μm), l’agente patogeno era in grado di attraversare il filtro sterile, ma non di crescere sui comuni terreni di crescita per batteri. Pertanto venne inizialmente classificato come virus. Nel 1962 poi, un gruppo di ricercatori guidati da Robert Chanock riuscì a coltivare M. pneumoniae su un terreno cell-free, permettendo la corretta classificazione attuale come micoplasma.
Secondo le ipotesi più accreditate, M. pneumoniae (e i micoplasmi in generale) è il risultato di un processo di evoluzione degenerativa di batteri Gram (+) e sono filogeneticamente vicini ai Clostridia.
Caratteristiche della membrana cellulare
Le cellule di M. pneumoniae sono caratterizzate da una membrana cellulare lipoproteica trilaminare (Figura 2) ricca di steroli e priva di peptidoglicano. Questa particolarità, oltre ad essere unica dei micoplasmi, li rende pertanto inadatti all’identificazione mediante colorazione di Gram e insensibili all’effetto degli antibiotici β-lattamici (che inibiscono appunto la sintesi della parete).
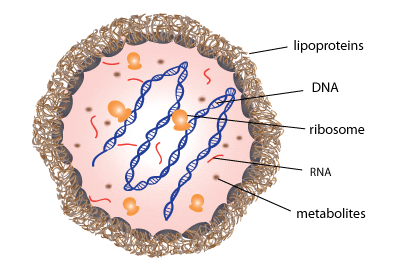
Il genoma di M. pneumoniae consta di sole 820.000 bp e 687 geni. La riproduzione avviene per scissione binaria preceduta dalla duplicazione dell’organello responsabile dell’aderenza alle cellule ospiti, il quale migra verso il polo opposto della cellula in divisione stimolando la motilità cellulare e la formazione della cellula figlia.
L’organello di adesione
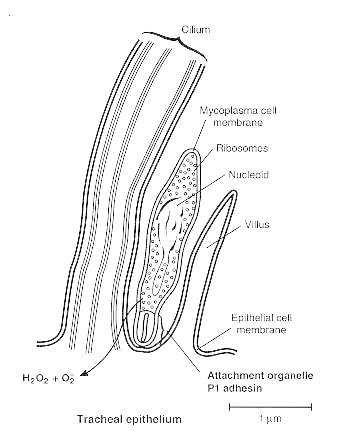
L’organello di adesione media inoltre l’interazione e l’eventuale (raro) ingresso all’interno delle cellule ospiti. Le proteine che lo compongono sono: P1, P30, P90, P40 le quali promuovono l’adesione alle cellule ospiti mediante i recettori SAR (Sialic Acid Receptor) e le proteine accessorie P200 e P41 che facilitano invece la motilità scivolante lungo la membrana cellulare dell’ospite. Inoltre, diversi studi hanno ipotizzato la presenza di un prolungamento bastoncellare di tale organello che termina con un complesso a forma di ruota, ricco di fibrille che si estendono nel citoplasma. Data la loro struttura, esse dovrebbero contribuire alla motilità cellulare (Figura 3), ma il meccanismo non è ancora del tutto chiaro.

M. pneumoniae non è mai stato isolato libero in natura. Per questo viene considerato un patogeno parassita delle mucose: sopravvive e si riproduce solo in adesione sulle cellule epiteliali dell’ospite. La citoaderenza, inoltre, protegge M. pneumoniae dall’espulsione mediante l’apparato mucociliare dell’epitelio polmonare, ne garantisce la sopravvivenza nell’ospite e media lo sviluppo della malattia.
Sono invece rari, ma noti, casi di internalizzazione di M. pneumoniae nelle cellule epiteliali polmonari.
Filogenesi
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Tenericutes |
| Classe | Mollicutes |
| Ordine | Mycoplasmatales |
| Famiglia | Mycoplasmataceae |
| Genere | Mycoplasma |
| Specie | pneumoniae |
Morfologia delle colonie
Le colonie di M. pneumoniae assumono una forma simile ad un uovo fritto (Figura 4), costituite da una zona centrale di crescita in cui la colonia penetra nell’agar e una zona periferica in cui le cellule restano in superficie. Questa morfologia è unica nel suo genere, perciò l’identificazione di M. pneumoniae è inequivocabile.

Nello specifico, M. pneumoniae viene coltivato su terreno di Eaton, contenente colesterolo essenziale per la sua crescita o su terreno specifico per micoplasmi.
Patogenesi
Come già detto, la patogenesi di M. pneumoniae è mediata dall’adesione sulla superficie dell’epitelio polmonare. Nello specifico, M. pneumoniae aderisce sull’epitelio ciliato dell’apparato respiratorio (Figura 5) mediante la principale proteina di adesione P1, coadiuvata dalle proteine di supporto P30, P90, P40. Queste proteine si legano alle nauroaminidasi e alle sialoglicoproteine presenti sulla superficie cellulare.
I meccanismi patogenici
Una volta aderito in superficie, i meccanismi patogenici (Figura 6) che portano allo sviluppo della malattia sono principalmente legati a:
- in primo luogo, lo stress ossidativo indotto dalla produzione di perossido di idrogeno (H2O2) e superossido (O2-), prodotti del metabolismo del glicerolo. Il perossido di idrogeno e il superossido causano infatti danno cellulare e tissutale a vari livelli: ad esempio negli eritrociti presenti nei vasi respiratori causano denaturazione dell’emoglobina, mentre nelle cellule epiteliali causano perossidazione lipidica e conseguente lisi cellulare. A livello tissutale invece comportano il deterioramento dell’apparato ciliare;
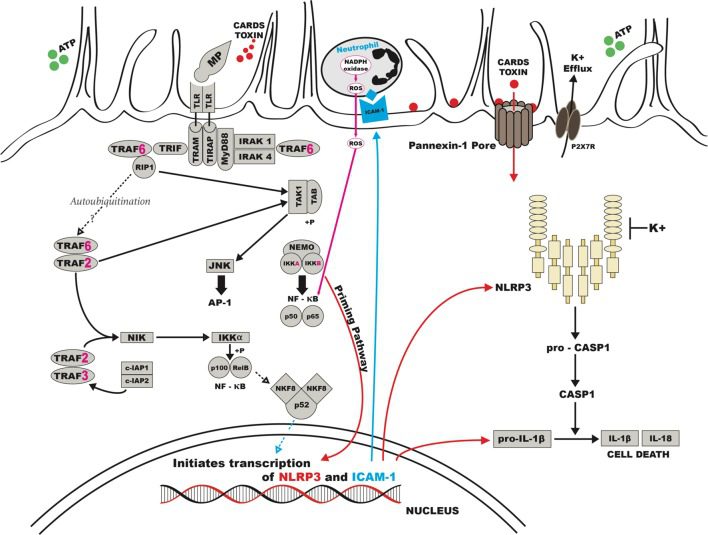
- in secondo luogo, la produzione di tossine definite CARDS (Community-Acquired Respiratory Distress Syndrome) che inducono citotossicità diretta sulle cellule epiteliali. Le tossine CARDS sono infatti in grado di legare i recettori TLR-2 o TLR-4 e indurre una cascata di segnale pro-infiammatoria (Figura 6) mediata dalla formazione di molecole di adesione intracellulare ICAM. La cascata di segnale porta alla produzione di citochine e chemochine pro-infiammatorie (IL-1-β) che, da un lato promuovono la vacuolizzazione e morte cellulare e dall’altro stimolano l’attività di macrofagi, linfociti e neutrofili che incrementano i meccanismi infiammatori contribuendo al danno tissutale;
- infine, la risposta immunitaria innata indotta dalla presenza di M. pneumoniae è mediata, inoltre, dai macrofagi i quali producono chemochine che attraggono linfociti e basofili a supporto nell’attività di contrasto al patogeno. Questo comporta un importante infiltrato plasmatico nelle aree peribrancovascolari (PBVAs), che è il segno di riconoscimento tipico delle infezioni da M. pneumoniae.
Manifestazioni cliniche
Le principali manifestazioni cliniche dell’infezione sono: tosse secca nello stadio iniziale che diventa sempre più progressiva fino a sfociare in tracheobronchite, faringite e a coinvolgere anche l’apparato respiratorio inferiore (polmoni). L’infezione può accompagnarsi poi a lieve febbre e in seguito sviluppare difficoltà respiratorie che molto spesso richiedono l’ospedalizzazione dei pazienti.
Inoltre, la polmonite da M. pneumoniae, che viene spesso definita “walking pneumonia“, può comportare anche sintomi extra-polmonari, come descritto nell’articolo dedicato.
Metodi di identificazione
Per quanto riguarda l’identificazione di M. pneumoniae, a scopo diagnostico vengono utilizzate principalmente le seguenti tecniche:
- amplificazione mediante PCR di geni specifici quali P1, 16S rDNA, 16S rRNA utilizzando campioni di secrezioni polmonari. Questa tecnica presenta elevate sensibilità e specificità ed è attualmente considerata il gold standard per l’identificazione di M. pneumoniae;
- test antigenici rapidi: basati sull’utilizzo di anticorpi monoclonali specifici per epitopi peculiari di M. pneumoniae come le proteine ribosomiali L7/L12 o la proteina di adesione P1. Questi test rapidi sono particolarmente utili negli stadi iniziali della patologia per indirizzare tempestivamente l’approccio terapeutico;
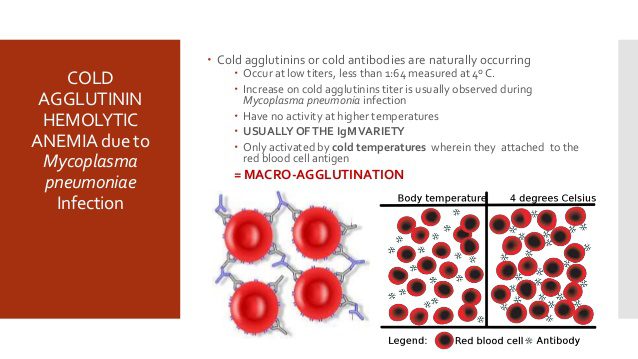
- indagini sierologiche: per verificare la presenza di anticorpi specifici (IgM o IgG) nel siero dei pazienti. Vengono quindi utilizzate principalmente tecniche come l’ELISA oppure l’emoagglutinazione a freddo (Figura 7)
- identificazione tradizionale mediante coltivazione su terreno specifico per micoplasmi. M. pneumoniae ha esigenze nutrizionali particolati, pertanto i terreni utilizzati per la coltivazione sono complessi: contengono agar cuore, peptone, estratto di lievito, sali, glucosio e siero di cavallo.
In questo caso, il campione di secrezione naso-faringeale viene inoculato in terreno liquido per micoplasmi con l’aggiunta di rosso fenolo. Quando M. pneumoniae cresce produce acidi che fanno virare il colore da viola a giallo: quando questo accade, e comunque una volta a settimana per 8 settimane dall’inoculo, delle aliquote vengono piastrate per valutare la comparsa delle colonie. Poiché questo procedimento è decisamente più lungo rispetto all’identificazione rapida mediante indagine sierologica e PCR, esso viene considerato di seconda elezione e/o di conferma per le prime due.
Terapia
Poiché M. pneumoniae è resistente agli antibiotici β-lattamici, per il trattamento vengono utilizzati antibiotici appartenenti alle classi delle teracicline (dossiciclina, minociclina), dei fluorochinoloni (ciprofloxacin, lamefloxacin) e dei macrolidi (azitromicina, eritromicina). In particolare, questi ultimi sono raccomandati per il trattamento sintomatico anche per il loro effetto antiinfiammatorio, sebbene spesso non si riesca ad ottenere una completa eradicazione dell’infezione.
In conclusione, l’utilizzo di steroidi in combinazione con macrolidi è raccomandato nei casi più severi di polmonite atipica causata da M. pneumoniae.
Fonti
- Chaudhry R, Ghosh A, Chandolia A. Pathogenesis of Mycoplasma pneumoniae: An update. Indian J Med Microbiol 2016;34:7-16
- Medjo B, Atanaskovic-Markovic M, Radic S, Nikolic D, Lukac M, Djukic S. Mycoplasma pneumoniae as a causative agent of community-acquired pneumonia in children: clinical features and laboratory diagnosis. Ital J Pediatr. 2014;40:104.
- Meyer Sauteur, P. M.; Unger, W.; van Rossum, A. M. C.; Berger, C. The Art and Science of Diagnosing Mycoplasma pneumoniae Infection, The Pediatric Infectious Disease Journal: November 2018 – Volume 37 – Issue 11 – p 1192-1195
- Parrott, Gretchen L et al. “A Compendium for Mycoplasma pneumoniae.” Frontiers in microbiology vol. 7 513. 12 Apr. 2016
- Razin S. Mycoplasmas. In: Baron S, editor. Medical Microbiology. 4th edition. Galveston (TX): University of Texas Medical Branch at Galveston; 1996. Chapter 37. Available from: https://www.ncbi.nlm.nih.gov/books/NBK7637/
VEDO QUALCHE LEGAME CON L’ ATTUALE EPIDEMIA DI COV19 ?