La parete cellulare è una delle strutture più conservate tra i batteri ed è il bersaglio per gli antibiotici che usiamo più frequentemente. E’ costituita dai peptidoglicani, polimeri di zuccheri azotati, i glicani, reticolati con peptidi a catena corta.Gli enzimi più noti responsabili della sintesi della parete erano fino ad ora le proteine che legano la penicillina (dall’inglese “penicillin binding proteins, PBPs”): sono transpeptidasi e partecipano alle fasi finali della sintesi del peptidoglicano. Hanno quindi un ruolo cruciale, che le ha rese bersaglio dei primi antibiotici beta-lattamici.
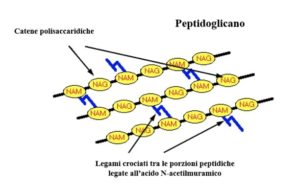
Le transpeptidasi sono gli enzimi che generano i legami crociati tra glicani e peptidi, ma chi è che sintetizza i glicani?
Si è scoperto che esistono due classi di PBP, A e B: le PBP di classe B sono semplici transpeptidasi, ma quelle di classe A presentano anche una funzione glicosiltrasferasica, necessaria per la sintesi dei glicani. Insomma, le PBP sembrerebbero avere tutte le carte in regola per occuparsi da sole dell’assemblaggio della parete.
Ma nel caotico mondo della biologia gli imprevisti sono sempre dietro l’angolo: per esempio, se sei un batterio ed è una giornata no, potresti incappare in uno scienziato curioso, che potrebbe decidere di bloccare l’espressione delle tue PBP di classe A , quelle con funzione glicosiltrasferasica; una bella scocciatura, poiché non saresti più in grado di sintetizzare in santa pace la tua preziosa parete…o forse no? L’esperimento è reale e risale a circa dieci anni fa, quando fu inaspettatamente scoperto che in Bacillus subtilis il blocco delle PBP di classe A non aveva nessun impatto significativo sulla crescita e divisione cellulari. C’era quindi una glicosiltrasferasi “mancante”, ancora sconosciuta, ma assolutamente in grado di sopperire al mancato funzionamento delle PBP.
Secondo uno studio pubblicato recentemente su Nature l’enzima mancante potrebbe RodA, una molecola che fa parte di una famiglia di proteine espresse in modo ubiquitario in diversi gruppi di batteri, ma dal ruolo ancora poco chiaro. RodA appartiene alle cosiddette proteine SEDS (“shape, elongation, division and sporulation), che come dice il nome stesso regolano la forma delle cellule e i processi di divisione. Ma non è l’unica funzione di RodA: diversi studi hanno dimostrato che questa molecola partecipa alla sintesi della parete batterica come polimerasi che sintetizza i filamenti di glicano.
Ma c’è di più: gli scienziati hanno scoperto che modificare anche solo di poco la struttura di RodA è per i batteri un problema ben più grande del blocco delle PBP di classe A. Sia in E. coli che in B. subtilis, gram-negativo e gram-positivo rispettivamente, queste variazioni causano una crescita incontrollata, fino a lacerazione della cellula. RodA sembrerebbe quindi fondamentale per la corretta crescita del batterio; questo, unito al suo carattere ubiquitario, ne fa un candidato promettente per una nuova generazione di antibiotici ad ampio spettro. Studiando la struttura di RodA i ricercatori hanno scoperto che presenta una specie di “tasca” sulla superficie, che potrebbe effettivamente ospitare una molecola: la sfida sarà quella di progettare una nuova molecola antibiotica in grado di legare la “tasca” e causare la perdita di funzione dell’enzima.
L’antibiotico-resistenza è uno dei problemi più grandi del nostro tempo e ogni anno sono circa 700000 le persone che muoiono per infezioni da batteri non più controllabili da questi farmaci. C’è chi pensa che l’era degli antibiotici sia ormai terminata: dopo la loro esplosione nella seconda metà del Novecento, ora sono diversi anni che non ne vengono scoperti di nuovi e le case farmaceutiche non sono particolarmente interessate a investire in questo settore. Ma abbiamo veramente detto tutto quello che c’era da dire? Oppure gli esperimenti su RodA segnano una nuova era per l’antibioticoterapia?
Erika Salvatori
Fonte:
Emami, K., et al. (2017). RodA as the missing glycosyltransferase in Bacillus subtilis and antibiotic discovery for the peptidoglycan polymerase pathway. Nat. Microbiol.