Il sistema CRISPR-CAS9 nei batteri
I batteri sono esseri viventi relativamente semplici: non sono dotati della complessità di organi ed apparati. Anche essi però, come gli organismi superiori, hanno necessità di difendersi da potenziali “nemici”, per esempio i virus.
Molti batteri in natura hanno sviluppato, nel corso dell’evoluzione, un particolare meccanismo di difesa, su cui si è cominciato a fare luce nel 1987 grazie a Ishino, e che è stato poi completamente compreso nel 2007, da Barrangou.
Il meccanismo, identificato dall’acronimo CRISPR-CAS9 nei batteri, si basa su due strutture che operano in sinergia. Tali strutture sono state individuate in molti ceppi batterici, per esempio E.coli, Halophiles e Clostridium.

CRISPR: Clustered Regurarly Interspaced Short Palindromic Repeats
La prima di queste strutture è contenuta in uno dei geni batterici, ed è costituita da brevi sequenze, uguali, ripetute e separate di DNA. Da qui l’acronimo CRISPR, Clustered Regurarly Interspaced Short Palindromic Repeats. Non c’è molto da aggiungere su questa definizione, è esattamente quella che si intuisce: una serie di sequenze uguali, ripetute e palindromiche di basi nucleiche.
CAS
La seconda struttura è definita CAS, CRISPR Associated Proteins e comprende il gruppo di proteine coinvolte nel meccanismo. Questa sigla indica un insieme di proteine che eseguono una sorta di “taglia e incolla”, proprio come quello globalmente utilizzato dai principali software di scrittura. La semplicità delle sigle è fortemente indicativa della semplicità del meccanismo.
Il processo di attivazione di CRISPR-CAS9 nei batteri
Il primo passaggio del processo si attiva quando la cellula è attaccata da un virus. Si attiva la prima proteina CAS che taglia e cattura un frammento del genoma del virus. Poi, portando con sé il segmento tagliato, si avvicina alla sequenza CRISPR, esegue un taglio preciso tra due subunità e salda tra le due il segmento di genoma virale. Infine, interviene la proteina CAS9, che si lega ad una copia del genoma virale e inizia a “pattugliare” lo spazio intracellulare.
Il processo si chiude quindi con l’archiviazione del frammento di genoma virale tra due elementi della catena CRISPR e con la generazione delle sentinelle CAS9, specifiche per quel frammento.
Quando un virus contenente la stessa sequenza genomica virale attacca la cellula, la CAS9 corrispondente riconosce la sua stessa sequenza e la taglia via, di fatto disattivando il virus.
A livello puramente teorico, questo sistema fa pensare ad un sistema automatico tramite il quale i batteri riescono a costruirsi una sorta di libreria, contenente degli identikit dei potenziali nemici, partendo da scaffali vuoti, tutti uguali, tutti predisposti per contenere la stessa quantità di informazioni. Un po’ come l’archivio sotterraneo dei dossier dei servizi segreti, un grande classico nei film di genere.
Il CRISPR-CAS9 nei batteri come strumento di gene-editing
Nel 2012 due team di ricerca della Berkeley University e del MIT di Boston hanno ipotizzato un utilizzo mirato di questo meccanismo, rendendolo un vero e proprio strumento di gene-editing guidato. La tecnologia ipotizzata è altrettanto semplice quanto il processo naturale che l’ha ispirata: diventa possibile modificare, sostituire o aggiustare geni specifici, con la stessa relativa semplicità con cui si esegue un copia-incolla in un testo.
Il processo in laboratorio parte dalla creazione in laboratorio di una copia del gene bersaglio da modificare, che viene poi incollato alla proteina CAS9.
Una volta iniettata la proteina nella cellula ospite, la CAS9 viene guidata dal RNA combinato fino al punto esatto dove tale sequenza è presente. A questo punto, la proteina CAS9, semplicemente, taglia il gene.
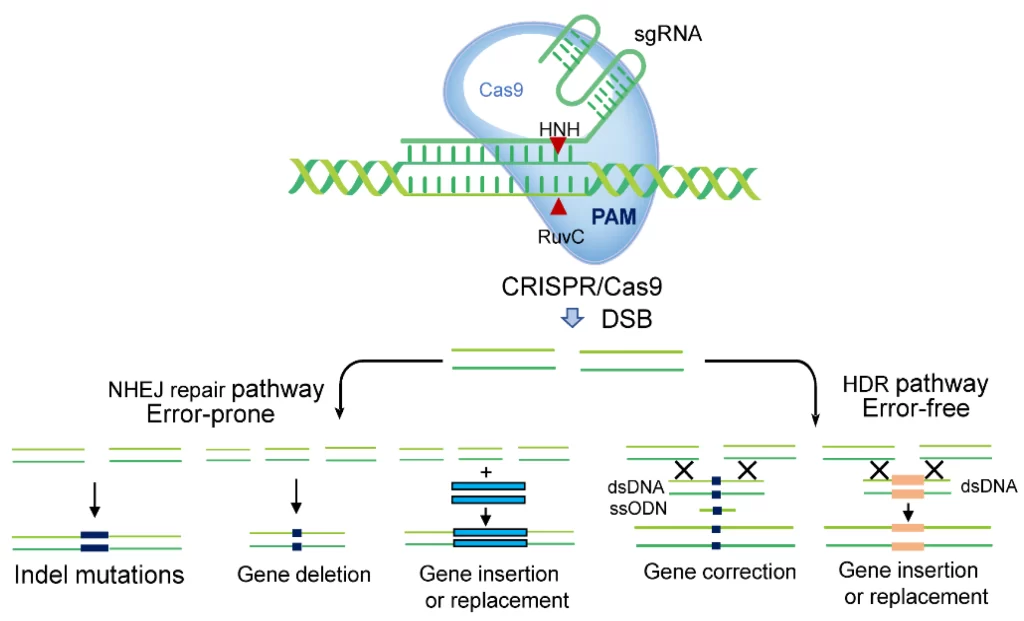
CRISPR-CAS9 nei batteri: un sistema non perfetto
In condizioni normali, in presenza di un gene danneggiato e tagliato, interviene un sistema di riparazione che usa un approccio non omologo. Questo approccio, non particolarmente accurato, può determinare la mancanza o l’aggiunta di alcune basi, o una trascrizione sbagliata. Quando si verifica uno di questi errori, come detto tutt’altro che sporadici, il gene risulta, di fatto, disattivato.
Già così, si intravede la possibilità di “spegnere” geni che determinano alcuni tipi di malattie o malformazioni.
Un sistema intelligente
È possibile però andare anche oltre: aggiungendo una sequenza di DNA “template” al mix iniettato, si attiva un processo di riparazione diverso, più preciso, definito omologo, nel quale il DNA template è utilizzato come se fosse un progetto. In questo modo, scegliendo il template opportuno, è possibile inserire la sequenza corretta o una sequenza completamente nuova.
Semplice come un’iniezione, precisa come un abito su misura.
Le nobel Emmanuelle Charpentier e Jennifer A. Doudna
Le scienziate responsabili dei team di ricerca, Emmanuelle Charpentier e Jennifer A. Doudna, sono state insignite del Premio Nobel per la Chimica 2020. La scoperta di questa applicazione apre scenari eccitanti e potenzialmente sconfinati in moltissimi campi. Intuitivamente, in primis nella ricerca sulle malattie di natura genetica, come la fibrosi cistica o la distrofia muscolare.
Ed è risultato del tutto naturale che, in seguito alla ricerca pubblicata nel 2012, il fermento scientifico sia esploso sfociando nella pubblicazione di migliaia di articoli sull’argomento e nella nascita, ovviamente con gli USA a capofila, di start up basate sulla nuova tecnologia e le sue pressoché infinite applicazioni. Infinite, perché questa tecnica si applica al DNA e di conseguenza, potenzialmente a tutti gli esseri viventi.
Scorrendo le bibliografie degli articoli, si può notare come i filoni di ricerca abbiano intrapreso, a tutta velocità, due strade principali, entrambe molto promettenti ma contemporaneamente accomunate dal fondo dissestato a causa di argomentazioni, polemiche e dilemmi etici.
Piante produttive e resistenti
Il primo dei due campi principali di applicazione è nella ricerca e nella creazione di specie vegetali e animali che possano aiutare a risolvere problemi di dimensioni talvolta globali. Lo studio si è focalizzato nella selezione di piante che possano essere più produttive, più resistenti sia al clima che ai parassiti, o nella creazione di insetti che non siano in grado di trasmettere malattie (per esempio, le zanzare con la malaria).
In questo caso, sono evidenti i vantaggi ottenibili rispetto alla lotta contro alcune piaghe globali. Diventa possibile procurare il nutrimento per le popolazioni di aree del globo afflitte dalla fame e dalle conseguenti malattie. In secondo luogo, si risolve almeno in parte il problema di assicurare il cibo per un pianeta sempre più popolato.
Le polemiche su questo strumento biotecnologico
D’altro canto, le polemiche si concentrano sull’utilizzo di questa tecnologia da parte di aziende private: la prima argomentazione è che, anche in questo caso, si usa una innovazione tecnologica per allargare ancora di più il divario di ricchezza tra il mondo ricco e quello invece privo di risorse. Inoltre, lo sfruttamento privato si concentrerebbe su un limitato numero di colture, di norma utilizzate nelle economie degli stati ricchi, per esempio per produrre mangimi per animali.
Un altro punto di discussione è relativo alla definizione di OMG, che a questo punto rischia di diventare essa stessa obsoleta. In questo caso infatti, anche se sarebbe scongiurato l’utilizzo di genomi trans-specie o addirittura trans-regno (per esempio, il famoso caso delle sementi modificate con DNA di batteri o insetti, per rendere i raccolti immuni all’attacco di parassiti o altre malattie), la tecnologia taglia-incolla non risulta ancora normata, anche perché può utilizzare tratti di genoma completamente sintetici. Si genera così un vuoto legislativo che permette il proliferare di prodotti non controllati né controllabili.
L’urgenza in questo aspetto normativo è dettata soprattutto dalla natura della tecnica, che riduce drasticamente il tempo di sviluppo delle nuove semenze, da anni a mesi.
L’enorme problema etico sull’applicabilità sull’essere umano
Il secondo campo di applicazione del CRISPR-CAS9, forse il primo in termini di importanza, è quello della applicazione sugli esseri umani.
Anche in questo caso, le prime applicazioni hanno dato immediatamente riscontri positivi. La mappatura del genoma umano ha ricevuto un’accelerazione esponenziale, in particolare nello studio delle malattie genetiche. Sono stati avviati nuovi studi per potenziali terapie ed il campo più fertile in questo momento sembra quello legato al sistema immunitario, dove, letteralmente, è possibile estrarre una cellula, “istruirla” tramite il CRISPR-CAS9 e una volta reimmessa nell’organismo, ottenere una modifica permanente: un esempio è quello delle Cell-T che possono diventare resistenti all’HIV.
Per gli studi riguardanti le altre malattie genetiche, alcuni team di ricerca hanno usato embrioni umani, mentre addirittura risulta da verificare l’esistenza dei primi bimbi nati con una modifica CRISPR-CAS9. L’utilizzo degli embrioni umani è regolato in maniera variegata nelle tante legislazioni nazionali, con cavilli, passaggi da comitati etici, eccezioni. La tecnica CRISPR-CAS9 risulta ancora talmente sperimentale da non essere stata ancora presa in considerazione dai legislatori in giro per il mondo.
L’eugenetica
Un ulteriore dilemma che sta nascendo è dovuto al naturale passaggio logico che collega la possibilità di tagliare e cucire il genoma di un individuo con il concetto discusso e discutibile dell’eugenetica.
La possibilità di creare un essere umano perfetto, meno vulnerabile alle malattie, più forte, più intelligente, in sintesi “superiore” agli altri, rimanda echi di follie genocide, deliri suprematisti, esperimenti diabolici, nemmeno troppo lontani nel tempo.
Questo punto è naturalmente quello che accende il dibattito più acceso, vista la distanza di questi scenari distopici dai principi di uguaglianza e universalità che stanno, faticosamente, prevalendo nel mondo.
La discussione dovrebbe forse partire dal ricordo delle innovazioni e dalle polemiche derivate dalle grandi scoperte scientifiche del passato. Ragionamenti simili vanno applicati a CRISPR-CAS9, che ha tutte le potenzialità per avere un impatto globale. Si giunga infine ad un piano filosofico ed antropologico, che investa, espandendosi, anche l’economia globale e la geopolitica.
Le nuove scoperte creano sempre implicazioni etiche
Come è naturale e già accaduto in altre occasioni nella storia, la scoperta di una tecnologia innovativa determina una accelerazione della ricerca in quel campo, aprendo allo stesso tempo un nuovo panorama di utilizzi.
Questo fenomeno, nelle epoche, è risultato ciclico e ripetitivo. È successo con la ruota, con il fuoco, ma anche con l’evoluzione delle armi: con la polvere da sparo, più di recente con la scoperta dell’energia nucleare.
Alcuni esempi nella storia
Ci sono stati casi nella storia, per i quali gli utilizzi sono risultati prevalentemente positivi. E’ il caso di un’altra grande scoperta sul DNA, relativamente recente, quella della Polimerase Chain Reaction (Kary Mullis, Premio Nobel per la Chimica 1993). Da questa sono derivati il test del DNA in ambito forense o in generale la possibilità di recuperare un genoma da tracce presenti in concentrazioni incredibilmente basse su matrici di natura quanto mai svariata.
In altri casi, come gli altri citati, è emerso lo stesso dilemma etico legato non tanto alla scoperta in sé o alle tecnologie che ne sono derivate, quanto alla possibilità di utilizzo per scopi contrari al bene comune (o supposto tale), ai principi di uguaglianza e fraternità che dovrebbero accomunare non solo le comunità scientifiche ma anche le popolazioni di tutto il mondo.
Non è nostra intenzione, in alcun modo, affiancare o solo confrontare la scoperta e l’applicazione della CRISPR-CAS9 a bombe, fucili o gas utilizzati in guerre e genocidi.
La nostra riflessione sul CRISPR-CAS9 nei batteri
Ci piacerebbe però stimolare una riflessione su quello che sembra emergere come un pattern rivisto: un passo avanti della scienza genera allo stesso tempo entusiasmo e scetticismo, che vanno a braccetto, sempre più veloci, generando di pari passo nuove applicazioni e nuove polemiche.
E proprio perché questo andamento è rivisto, come una marea che sale ciclicamente, che la comunità internazionale, scientifica e non, deve aver acquisito l’esperienza per affrontare in maniera serena la situazione. Secondo noi, è esattamente questo il momento giusto per valutare dettagliatamente tutte le questioni possibili riguardo le applicazioni CRISPR-CAS9, dedicando a ciascuna le risorse necessarie.
Per usare al meglio le applicazioni delle scoperte presenti, si considerino alla luce di quanto avvenuto in passato.
Conclusioni
La Scienza, studiando il presente può vedere il futuro; la Storia, studiando il passato può analizzare il presente. Solo il progresso armonico di scienza, etica, filosofia permetterà di sperare in un futuro per il pianeta, la biosfera e il genere umano.
Fonti
- Ishino, Yoshizumi, et al. “Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product.” Journal of bacteriology 169.12 (1987): 5429-5433
- Barrangou, Rodolphe, et al. “CRISPR provides acquired resistance against viruses in prokaryotes.” Science 315.5819 (2007): 1709-171
- Charpentier, E., Doudna, J. Rewriting a genome. Nature 495, 50–51 (2013)
- Vladimir Nekrasov. Tomelo- rapid generation of a tomato resistant to the powdery mildew by genome editing. CRISPR/Cas Workshop, 7-8 September 2015, John Innes Centre, Norwich (GB)
- Liang, Puping, et al. “CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes.” Protein & cell (2015): 1-10
- Schumann, Kathrin, et al. “Generation of knock-in primary human T cells using Cas9 ribonucleoproteins.” Proceedings of the National Academy of Sciences (2015)
- Gantz, Valentino M., et al. “Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi.” Proceedings of the National Academy of Sciences 112.49 (2015)
- https://www.microbiologiaitalia.it/varie/crispr-cas9-per-la-talassemia-primo-caso-in-italia/