La tavola periodica degli elementi chimici è uno schema in cui tutti gli elementi noti fino ad oggi sono stati ordinati secondo delle regole ben precise.
La materia è formata da atomi
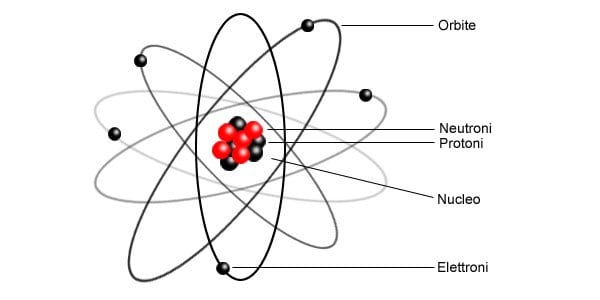
Tutta la materia che ci circonda è formata da particelle invisibili a occhio nudo dette atomi, i quali contengono al loro interno alcune particelle ancora più piccole, chiamate particelle subatomiche:
- i protoni (p), particelle dotate di carica elettrica positiva (+);
- gli elettroni (e), particelle con carica elettrica negativa (-);
- i neutroni (n), particelle neutre, cioè prive di carica elettrica.
I protoni e i neutroni sono raggruppati insieme al centro dell’atomo a formare il nucleo, mentre gli elettroni si muovono intorno al nucleo in regioni di spazio chiamate orbitali.
[Fonte: https://www.biopills.net/]
Gli elementi chimici
Gli atomi non sono tutti uguali, ma possono differire per il numero di protoni e di neutroni che compongono il nucleo. Gli atomi con lo stesso numero di protoni individuano un elemento chimico, che si può presentare in “forme” diverse, con un numero di neutroni diverso. Oggi, gli atomi conosciuti hanno da 1 a 118 protoni, pertanto oggi conosciamo 118 tipi diversi di elementi chimici: 94 sono stati trovati in natura, 24 sono stati prodotti in laboratorio.
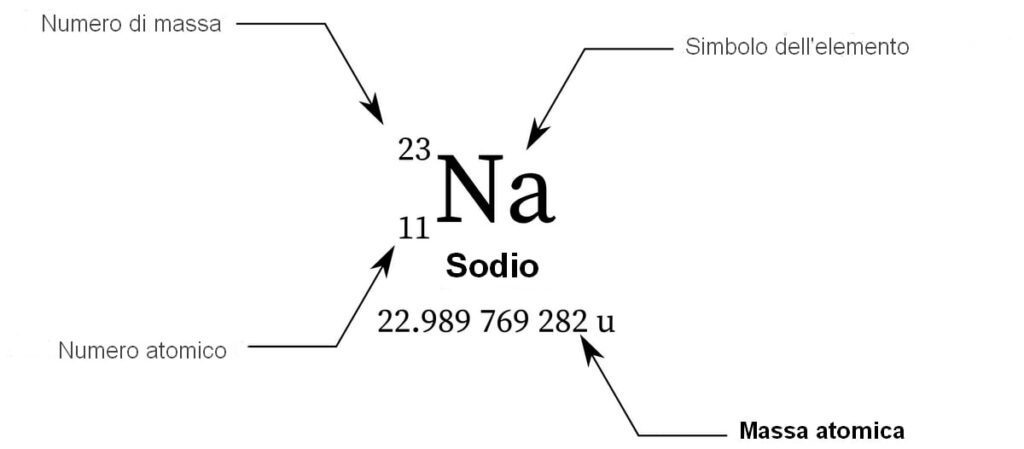
Inoltre, a ogni elemento chimico è associato un simbolo chimico, cioè un’abbreviazione che lo rappresenta a livello mondiale. Il simbolo con cui viene indicato un elemento chimico può essere costituito da una lettera maiuscola (O, C, H,…) o da due lettere, di cui la prima maiuscola e la seconda minuscola (He, Ne, Be,…).Per distinguere gli atomi dei diversi elementi chimici osserviamo due particolari numeri:
- numero di massa (A): indica il numero complessivo di protoni e neutroni di un atomo. Il numero di massa è definito così, in quanto la somma di protoni e neutroni in un atomo determinano la massa dell’atomo stesso.
Il numero di massa (A) è riportato sotto il simbolo dell’elemento chimico di appartenenza. - numero atomico (Z): indica il numero di protoni contenuti nel nucleo ed è riportato in alto al simbolo chimico di appartenenza.
Gli atomi di uno stesso elemento che hanno un diverso numero di neutroni nel nucleo si chiamano isotopi.
[Fonte: https://www.scuola-e-cultura.it/]
La tavola periodica di Mendeleev
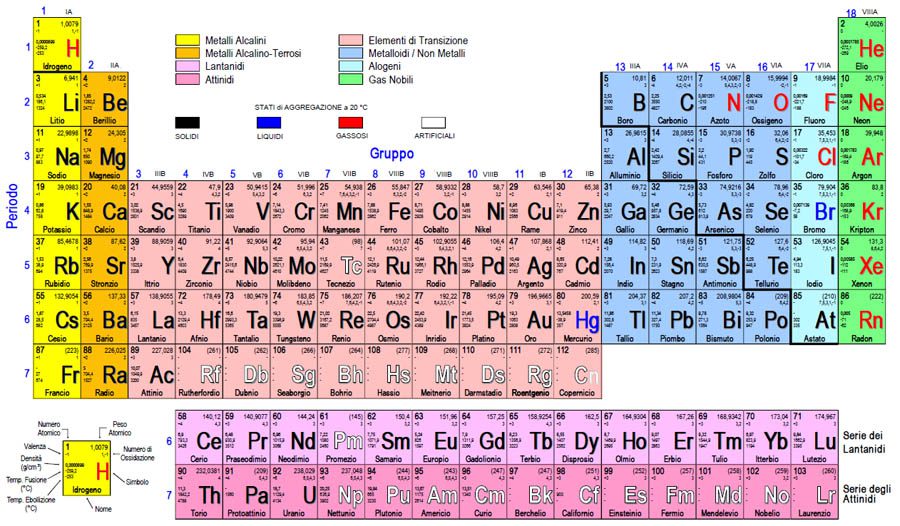
Tutti gli elementi chimici noti sono stati ordinati in uno schema ben preciso che viene chiamato tavola periodica, ideato nel 1869 dal chimico russo Dimitrij Mendeleev, il quale nel momento in cui ideò tale schema lasciò degli spazi vuoti in quanto sapeva che fino a quel momento non erano ancora stati scoperti tutti gli elementi chimici che conosciamo oggi.
[Fonte: https://www.accattatis.net/]
Gli elementi chimici nella tavola periodica di Mendeleev sono ordinati in 18 colonne verticali, chiamate gruppi, e in 7 righe orizzontali, chiamate periodi. Ogni gruppo e ogni periodo sono indicati con un numero. Gli elementi che appartengono allo stesso gruppo hanno proprietà chimiche simili, mentre gli elementi che appartengono allo stesso periodo mostrano alcune particolari “tendenze”. Per esempio, spostandosi da sinistra verso destra all’interno di un periodo si può osservare che la massa degli atomi degli elementi aumenta.
Come si distinguono gli elementi della tavola periodica
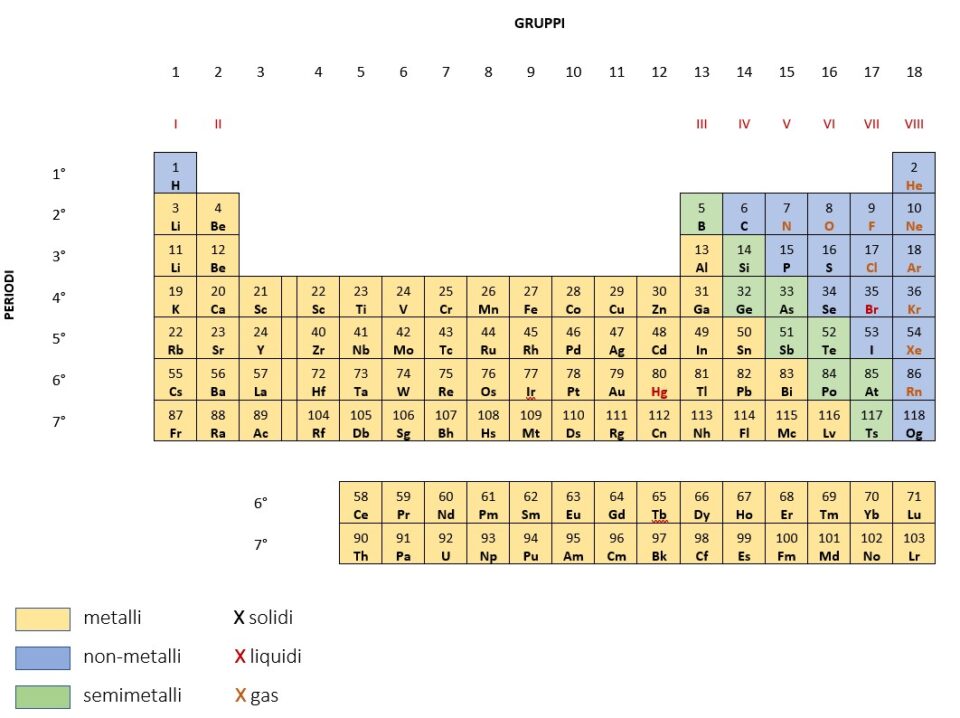
Gli elementi chimici della tavola periodica sono raggruppati, in base ad alcune proprietà fisiche, come la capacità di condurre calore ed elettricità e la capacità di deformarsi in maniera elastica o plastica, in tre classi principali:
- metalli: sono lucenti e a temperatura ambiente sono solidi (tranne per alcune eccezioni come il gallio (Ga) e il mercurio (Hg)). I metalli sono buoni conduttori di calore ed elettricità, sono malleabili, cioè possono essere lavorati in lamine sottili, e duttili, cioè possono essere ridotti in fogli molto sottili.
- non metalli: non sono lucenti e quindi non riflettono la luce, possono essere opachi (come il carbonio (C)) o trasparenti (come l’ossigeno (O)). La maggior parte dei non metalli a temperatura ambiente è allo stato solido, come lo zolfo (S) e il carbonio (C); alcuni sono allo stato gassoso, come l’ossigeno (O) e l’azoto (N); uno, invece, il bromo (Br) si trova allo stato liquido. Quando sono solidi non sono malleabili. I non metalli sono isolanti, cioè sono dei cattivi conduttori di calore ed elettricità.
- semimetalli: hanno proprietà intermedie tra quelle dei metalli e quelle dei non metalli. Alcuni semimetalli hanno lucentezza metallica ma sono meno duttili dei metalli. Altri, come il silicio (Si), variano la loro capacità di condurre l’elettricità con la temperatura, cioè ad alta temperatura conducono l’elettricità, a bassa temperatura sono isolanti.
[Fonte: https://www.infodit.it/]
La configurazione elettronica degli atomi
Dobbiamo sapere però che negli atomi, gli elettroni si distribuiscono intorno al nucleo in particolari regioni di spazio, chiamate gusci elettronici. I gusci elettronici sono una serie di sfere concentriche al centro delle quali si trova il nucleo. Questa rappresentazione, però, è una semplificazione perché nella realtà i gusci hanno al loro interno uno o più orbitali atomici che hanno una forma tridimensionale complessa e diversa tra loro. In ciascun orbitale troviamo al massimo 2 elettroni. Quindi, il numero massimo di elettroni che può entrare in un guscio dipende dal numero dei suoi orbitali. Il guscio più vicino al nucleo, avendo un solo orbitale, può contenere al massimo 2 elettroni, mentre il secondo e il terzo guscio hanno quattro orbitali ciascuno e possono quindi ospitare fino a 8 elettroni; il quarto e il quinto guscio possono contenere fino a 32 elettroni.
La distribuzione degli elettroni nei diversi gusci e orbitali viene chiamata configurazione elettronica dell’atomo e dipende dal numero atomico (Z) dell’elemento.

[Fonte: https://www.alamy.com/]
Possiamo immaginare gli orbitali come delle vere e proprie nuvole, all’interno delle quali si trovano gli elettroni. Gli orbitali aumentano di dimensioni mano a mano che ci si allontana dal nucleo e la loro forma diventa sempre più complessa.
Nel primo guscio di un atomo è presente un solo orbitale di forma sferica. Nel secondo guscio sono presenti un orbitale di forma sferica e tre orbitali a forma di doppio lobo. E via dicendo.
Gli orbitali che hanno forma sferica sono detti orbitali orbitali di tipo s, quelli a doppio lobo sono detti di tipo p e quelli più complessi che presentano quattro lobi sono detti di tipo d.
I legami chimici tra gli elementi presenti nella tavola periodica e la regola dell’ottetto
In natura, gli atomi raramente restano isolati; in genere, li troviamo riuniti con altri atomi a formare elementi e composti più stabili. Ciò che tiene uniti gli atomi sono forze di tipo elettrico, che chiamiamo legami chimici.
I legami chimici possono essere di vario tipo:
- Legame covalente: si forma quando due atomi mettono in comune una coppia di elettroni.
- Legame ionico: si forma quando un atomo cede uno o più elettroni a un altro atomo.
- Legame metallico: è dovuto all’attrazione elettrostatica che si instaura tra tutti i nuclei degli atomi del metallo (di carica elettrica positiva) e gli elettroni vaganti (di carica negativa).

[Fonte: https://slideplayer.it/]
La capacità degli atomi di legarsi tra loro dipende dagli elettroni che si trovano nel guscio più esterno di ciascun atomo, e in particolare dagli elettroni che si trovano negli orbitali di tipo s e p del guscio esterno, che sono detti elettroni di valenza. Questi elettroni sono in tutto al massimo 8 e nel loro insieme vengono chiamati “ottetto“. Se in un atomo l’ottetto non è completo (cioè se gli elettroni dei livelli s e p sono meno di 8), l’atomo tende a legarsi con un altro atomo (o più di uno) cercando di completare l’ottetto. Questa regola pratica, che spiega la formazione dei legami chimici, è chiamata regola dell’ottetto. Gli elementi che possiedono il guscio esterno completo sono quelli del gruppo 18, chiamati gas nobili.
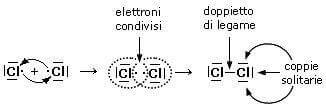
[Fonte: https://www.chimica-online.it/]
Conclusioni
Possiamo, quindi, concludere che la tavola periodica degli elementi chimici è un vero e proprio schema in cui tutti gli elementi naturali e sintetizzati in laboratorio vengono ordinati secondo delle proprietà fisiche e chimiche ben precise.
Fonti
- https://online.scuola.zanichelli.it/concettimodelliblu-files/presentazioni/pdf/Valitutti_concettiblu_sistema_periodico_cap12.pdf
- https://www.andreaminini.org/chimica/tavola-periodica
Crediti immagini
- Figura 1: https://www.biopills.net/wp-content/uploads/2016/01/atomo.jpg
- Figura 2: https://www.scuola-e-cultura.it/wp-content/uploads/2022/09/massa-atomica.jpeg
- Figura 3 e immagine in evidenza: https://www.accattatis.net/immagini/tavola2.jpg
- Figura 4: https://www.infodit.it/wp-content/uploads/2021/10/tavola-periodica-metalli-non-metalli-e-semimetalli-2-960×718.jpg
- Figura 5: https://c8.alamy.com/compit/2b7m2nj/rappresentazione-3d-della-struttura-dell-atomo-di-francio-isolato-su-protoni-di-sfondo-bianco-sono-rappresentati-come-sfere-rosse-neutroni-come-sfere-gialle-elettroni-come-2b7m2nj.jpg
- Figura 6: https://slideplayer.it/slide/12802332/77/images/2/I+tre+modelli+del+legame+chimico.jpg
- Figura 7: https://www.chimica-online.it/download/immagini_download/legame_covalente_singolo.jpg