Questa storia inizia negli anni ’30 del ‘900, in America. In uno scenario di malattie, farmaci e norme molto diverso da quello attuale. Iniziavano a circolare farmaci che permettevano di curare malattie infettive fino ad allora mortali. La sulfanilamide infatti è una molecola antibatterica utilizzata per la cura di infezioni.
Caratteristiche chimiche della sulfanilamide

La sulfanilamide è una molecola prodotta per sintesi chimica e fa parte della classe dei sulfamidici. Interferisce con la sintesi dell’acido folico (sostanza importante per il metabolismo dei batteri) perché è un analogo all’acido p-amminobenzoico (PABA). In sostanza l’enzima che dovrebbe legare PABA per dare origine a vari prodotti, lega al suo posto la sulfanilamide. Si tratta della cosiddetta inibizione competitiva, difatti la sulfanilamide compete con il vero substrato dell’enzima. In questo modo blocca la reazione e determina un rallentamento nella proliferazione dei batteri.
Dato che l’essere umano non sintetizza l’acido folico ma lo introduce con la dieta, la sulfanilamide ha una bassa tossicità.
Avvelenamento di massa
Se la sulfanilamide è innocua perché nel 1937 causò la morte di 105 persone in 15 Stati americani?
Negli anni ’30 veniva utilizzata per curare le infezioni da Streptococco ed era venduta sotto forma di pastiglie o polvere. Per poterla somministrare anche ai bambini o a persone con difficoltà di deglutizione venne richiesta una formulazione liquida. Il chimico della S.E. Massengill Company, Harold Cole Watkins, si occupò di sviluppare una formulazione di sulfanilamide liquida. Dopo una serie di esperimenti si accorse che era solubile in glicole dietilenico. Eseguì quindi controlli di laboratorio sulla fragranza, sul sapore e sull’apparenza e li giudicò soddisfacenti. L’azienda spedì dunque l’Elisir in tutta l’America.

Peccato però che il glicole dietilenico sia tossico. È un composto dal sapore dolciastro, utilizzato anche come liquido antigelo.
La prima ad accorgersene fu l’AMA (American Medical Association), che ricevendo segnalazioni da alcuni medici, analizzò nei suoi laboratori l’Elisir (composto per il 10% da sulfanilamide, 75% da glicole dietilenico e per il restante da coloranti e aromatizzanti) ed eseguì degli studi su animali, testando separatamente i componenti. Si rese quindi conto che l’elemento tossico e mortale era il glicole dietilenico. Diramò immediatamente un allarme tramite la radio e i giornali.
Il ruolo dell’FDA
Sorge spontaneo chiedersi come sia possibile che un farmaco sciolto in un liquido tossico potesse essere commercializzato.
In quell’epoca i nuovi farmaci non avevano l’obbligo di essere testati per la sicurezza, esisteva solo l’obbligo di riportare sull’etichetta la composizione del prodotto. Non era dunque illegale vendere farmaci tossici. Il chimico Watkins non si accorse che la nuova formulazione era di fatto un veleno poiché l’azienda non svolse degli studi farmacologici. L’FDA non aveva nessun controllo sui nuovi farmaci che venivano immessi sul mercato. La normativa infatti si rifaceva al Pure Food and Drugs Act del 1906, il quale introduceva delle novità importanti ma era ancora troppo grezzo e consentiva comunque la circolazione di prodotti tossici.
Dopo la diramazione dell’allarme da parte dell’AMA, l’FDA inviò degli ispettori alla sede centrale della S.E. Massengill Co. e scoprì che l’azienda aveva già avvertito tramite telegramma medici e farmacisti. Tuttavia richiedeva il ritiro del prodotto, senza specificare che il farmaco fosse letale. L’FDA ordinò quindi all’azienda di inviare un secondo telegramma per informare del pericolo mortale dell’Elisir.
Gli effetti sull’organismo
La sulfanilamide presente nell’Elisir non ha effetti tossici sull’organismo umano, l’elemento mortale è il glicole dietilenico. I sintomi dell’avvelenamento sono prevalentemente a carico dei reni. Si verificano danni a causa della formazione di ossalati di calcio, con arresto delle urine per ostruzione e forte dolore addominale, che sfociano in una insufficienza renale acuta. Altri effetti comprendono sintomi a carico del sistema cardiopolmonare e nervoso (nausea, vomito e convulsioni, fino al coma).
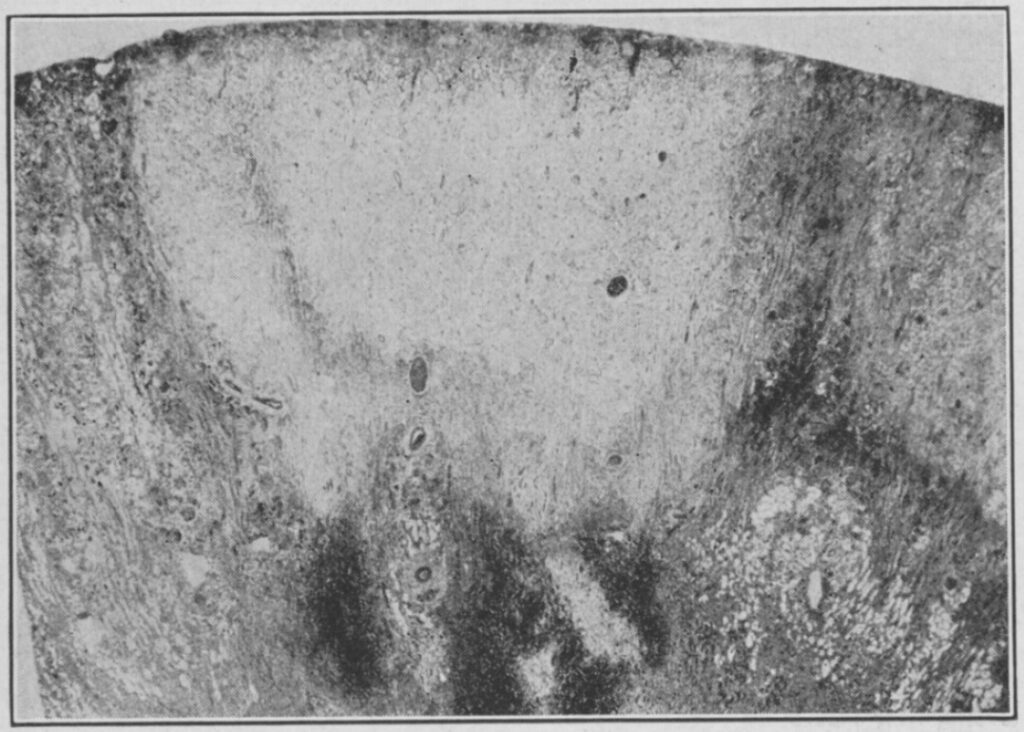
Nel 1937 non esisteva un antidoto all’avvelenamento da glicole dietilenico. I bambini e gli adulti che avevano dunque assunto l’Elisir di sulfanilamide per curare ad esempio una infezione alla gola, soffrirono per settimane per poi morire per gli effetti dell’avvelenamento. Oggi in caso di avvelenamento da liquido antigelo, i medici somministrano fomepizolo o etanolo, seguito da emodialisi. Fomepizolo o etanolo si legano all’enzima alcol deidrogenasi, al posto del glicole dietilenico che non viene metabolizzato e causa quindi meno danni all’organismo. Lo stesso protocollo si applica in caso di avvelenamento da metanolo.
La ricerca dell’Elisir di sulfanilamide
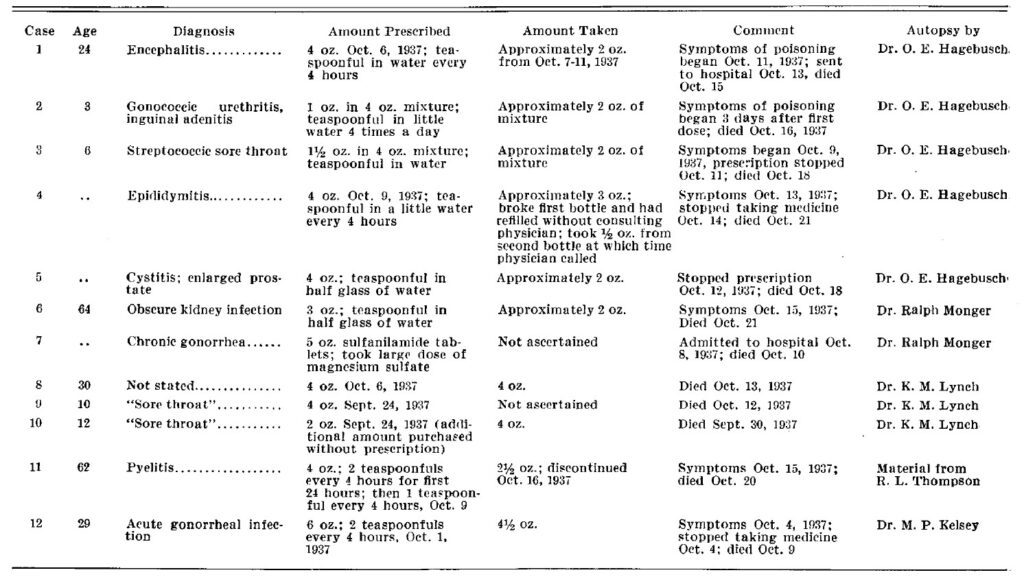
Gli ispettori dell’FDA cercarono di risalire ai punti vendita in cui erano stati spediti gli Elisir per poi identificare i cittadini che li avevano acquistati. Non fu facile risalire a tutte le persone. Infatti a volte mancava la prescrizione e il farmacista non conosceva il nome dell’acquirente, quando invece c’era la prescrizione del medico, i dati erano incompleti, mancavano nomi o indirizzi (ad es. Betty Jane 9 mesi o Mrs Jackson). Anche quando gli ispettori identificavano l’acquirente finale, faticavano a capire che fine avesse fatto l’Elisir. È il caso di una donna che disse di essersi sbarazzata della boccetta buttandola dalla finestra. In realtà, gli ispettori la trovarono intatta, in casa, con quantità di Elisir ancora sufficiente per uccidere un bambino.
Senza contare i medici non collaborativi che negavano di aver prescritto l’Elisir o sottostimavano la quantità prescritta per paura di incorrere in conseguenze. Altri medici invece aiutarono gli ispettori ad identificare gli acquirenti. Addirittura un medico ritardò il suo matrimonio per aiutare l’FDA a trovare una famiglia con un bambino di 3 anni che dopo l’acquisto dell’Elisir si era recata in montagna.

Alla fine della ricerca, l’FDA recuperò circa 887 litri di 900 venduti; i restanti erano stati consumati e causarono le 105 vittime.
Il retaggio dell’Elisir di sulfanilamide
Come finì la storia dell’Elisir e che cambiamenti comportò?
L’azienda non poteva essere accusata di aver venduto un farmaco tossico poiché di fatto non era proibito. L’FDA poté ritirare il farmaco dal mercato soltanto poiché era stato erroneamente denominato elisir ma non conteneva alcol etilico, come prevedeva la definizione. Si rese evidente l’inadeguatezza delle norme che vennero aggiornate con il Federal Food, Drug, and Cosmetic Act, del 1938. Con questo nuovo atto l’FDA stabiliva che i nuovi farmaci immessi sul mercato dovevano avere prove a supporto della loro sicurezza. Naturalmente ci sono voluti altri steps per arrivare alle attuali norme e bisognerà passare anche attraverso un altro scandalo, quello del Talidomide.
Samual Evans Massengill, proprietario della S.E. Massengill Co., negò ogni responsabilità dell’azienda sostenendo che avevano messo a punto un prodotto per soddisfare una domanda di mercato e che, l’incidente che si era verificato, non era prevedibile. In realtà gli effetti tossici del glicole dietilenico erano già noti in letteratura. Purtroppo Harold Watkins, il chimico che aveva sviluppato il prodotto, si suicidò dopo aver appresso delle morti causate dall’Elisir di sulfanilamide.
Fonti
- Pathologic effects of Elixir of Sulfanilamide (diethylene glycol) poisoning. Geiling e Cannon, 1938
- Sulfanilamide Disaster. FDA Consumer magazine June 1981 Issue, By Carol Ballentine
- Elixirs, Diluents, and the Passage of the 1938 Federal Food, Drug and Cosmetic Act. Wax, 1995
- Diethylene glycol poisoning. Schep et al, 2009
- https://www.msdmanuals.com/it-it/professionale/multimedia/table/sintomi-e-trattamento-di-intossicazioni-specifiche
Fonti delle immagini
- Immagine in evidenza: https://upload.wikimedia.org/wikipedia/commons/4/40/Elixir_
- Figura 1: https://upload.wikimedia.org/wikipedia/commons/thumb/5/5b/skeletal.svg/1920px-skeletal.svg.png
- Figura 2: https://www.researchgate.net/publication/231968184/figure/fig1/AS:1108249579397120@1641238698057/An-Elixir-Label-1937-RG-246-National-Archives.png
- Figura 3: https://jamanetwork.com/journals/jama/article-abstract/282251
- Figura 4: https://jamanetwork.com/journals/jama/article-abstract/282251
- Figura 5: https://uselessinformation.org/wp-content/uploads/2017/10/Calhoun.jpg