I TLRs eucariotici, in seguito al loro legame con i PAMPs, innescano numerose vie di trasmissione del segnale le quali attivano altrettanti fattori di trascrizione implicati nella risposta immunitaria eucariotica.
Continuiamo, quindi, il nostro viaggio nell’immunologia e scopriamo quali vie di trasmissione del segnale sono attivate dall’interazione tra i PAMPs ed i TLRs.
La trasmissione del segnale derivante dal legame tra i PAMPs ed i TLRs permette la produzione di fattori chemiotattici, di peptidi antimicrobici, di citochine infiammatorie e delle citochine antivirali, chiamate interferone α (IFN – α) ed interferone ß (IFN – ß).
L’avvio della trasmissione del segnale indotta da TLR avviene in seguito alla dimerizzazione di due ectodomini TLR indotta da uno dei ligandi PAMPs: tale dimerizzazione rende fisicamente vicini i domini TIR i quali possono, ora, interagire con i domini TIR di molecole citoplasmatiche dette adattatrici: MyD88 (fattore 88 di differenziazione mieloide), MAL (MyD88 adattatore – simile), TRIF (adattatore che induce IFN – ß contenente il dominio TIR) e TRAM (molecola adattatrice correlata a TRIF).
È importante sottolineare che TLRs diversi interagiscono con diverse combinazioni di tali molecole adattatrici: per esempio, TLR3 interagisce con TRIF; TLR5, TLR7 e TLR9 possono interagire solo con MyD88; gli altri TLRs utilizzano TRIF accoppiato con TRAM oppure MyD88 accoppiato con MAL; TLR4 può utilizzare, per l’attivazione della via di trasmissione del segnale, entrambe le coppie di molecole adattatrici Myd88/MAL oppure TRIF/TRAM; infine, la trasmissione del segnale derivante dagli eterodimeri TLR2/TLR1 e TLR2/TL6 richiede, per la sua attivazione, l’azione delle molecole adattatrici MyD88/MAL.
- La via di trasmissione del segnale innescata dai TLRs che utilizzano l’adattatore MyD88
La molecola adattatrice MyD88 possiede due domini proteici direttamente responsabili della sua attività di adattatore nella via di trasmissione del segnale: il dominio di morte – il cui nome trova ragione nel fatto che fu identificato, per la prima volta, nelle proteine coinvolte nell’apoptosi – al terminale amminico ed il dominio TIR al terminale carbossilico. Il dominio TIR di MyD88 interagisce con il dominio TIR del TLR. Il dominio di morte interagisce con i domini di morte di due proteine chinasi serina – treonina, IRAK4 e IRAK1 e ne permette l’attivazione. Le proteine IRAK reclutano una E3 ubiquitina lipasi, chiamata TRAF6. TRAF6 agisce con la ligasi TRICA1 generando una catena di poliubiquitina sulla proteina NEMO (NFkB essential modifier, anche indicata come IKKγ). Quest’ultima lega, attivandola, la chinasi serina – treonina TAK1.
TAK1 fosforila il complesso proteico IκB chinasi, chiamato IKK, composto dalle proteine IKKα, IKKß e IKKγ (NEMO stesso, vedi prima). Il complesso IKK, fosforilato, fosforila ed attiva IκB, che permette il rilascio di NFκB. Dal citoplasma, NFκB si sposta al nucleo dove può attivare la trascrizione dei geni che codificano per alcune citochine infiammatorie, quali TNF – α, IL – 1ß ed IL – 6.
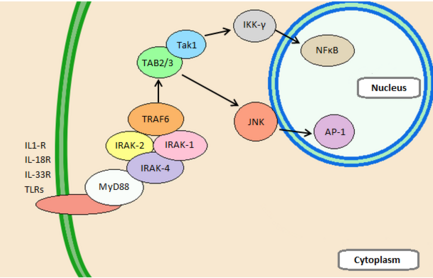
Le mutazioni a carico dei domini di morte e dei domini TIR di MyD88 e le mutazioni inattivanti in IRAK4 generano, negli esseri umani, immunodeficienze caratterizzate da infezioni batteriche ricorrenti.
- La via di trasmissione del segnale stimolata dagli acidi nucleici virali
I TLR7, TLR8 e TLR9, che riconoscono e legano gli acidi nucleici dei virus, possono innescare la via di trasmissione del segnale mediante l’uso dell’adattatore MyD88. Tale via attiva i fattori di trascrizione IRF, che determinano la produzione degli interferoni antivirali di tipo I. Il TLR3, che riconosce molecole di RNA a doppio filamento (dsRNA, double strand RNA), può trasmettere il segnale mediante l’utilizzo della molecola adattatrice TRIF. TRIF lega, attivandole, la chinasi IκKε e TBK1, le quali fosforilano IRF3. Tale fosforilazione induce l’espressione di IFN – 1ß.
L’ampio repertorio degli TLRs può stimolare sia risposte immunitarie antibatteriche sia risposte immunitarie antivirali. In questa versatilità, anche, risiede il motivo per cui tali molecole recettoriali sono evolutivamente altamente conservate.
Maria Chiara Langella
Immagine in evidenza da https://pdb101.rcsb.org/motm/143
Fonte: Immunobiologia di Janeway. Kenneth Murphy. Piccin. 89 – 92