Obiettivo della tecnica
La colorazione di Wright-Giemsa viene utilizzata quando bisogna analizzare campioni freschi di fluidi corporei umani o animali quali sangue intero, feci o liquido cerebrospinale, con lo scopo di ricercare alcune specie parassite eventualmente presenti che siano indifferentemente di tipo procariote oppure eucariote.
Questa tecnica è infatti molto versatile e viene utilizzata nella pratica clinica come strumento diagnostico per individuare i più comuni parassiti del sangue, oltre che per le clamidie, per le rickettsie e per il genere Borrelia di cui fa parte l’agente eziologico della malattia di Lyme.
Inoltre permette d’identificare la presenza delle principali specie di Pneumocystis (un fungo patogeno per l’uomo), dà ottimi risultati nella ricerca diagnostica della Dientamoeba fragilis (un’ameba parassita dell’intestino umano), nonché per i più comuni protozoi flagellati parassiti del tratto intestinale.
Data la sua versatilità, è inoltre usata per la diagnosi di malaria perchè permette di evidenziare senza ambiguità la presenza di Plasmodium falciparum.
Ultima applicazione ma non certo in ordine d’importanza, si ha per la ricerca di parassiti del genere dei Toxoplasma, protisti di cui fa parte l’agente eziologico della temuta toxoplasmosi.
La colorazione di Wright-Giemsa non è invece applicabile in presenza di altri tipi di parassiti, siano essi protozoici, fungini o batterici.
Che cos’è e come funziona
La colorazione di Wright-Giemsa nasce dalla combinazione di due diverse tecniche che provengono dall’ambito dell’Istologia umana e della Citogenetica: la colorazione di Wright (utilizzata per la differenziazione ed il conteggio delle cellule del sangue) e la colorazione di Giemsa.
Entrambi gli scienziati di cui porta il nome, Gustav Giemsa (1867-1948) e James Homer Wright (1869-1928), misero a punto le rispettive tecniche basandosi sullo stesso lavoro precedente, quello del medico russo Dmitri L. Romanowsky (1861-1921), il primo ad utilizzare il colorante principale di questa tecnica, il blu di metilene, nell’osservazione al microscopio per la diagnosi delle malattie del sangue.
La colorazione di Wright-Giemsa è cosiddetta differenziale, in quanto utilizza ben tre coloranti diversi (blu di metilene, azzurro B ed eosina Y) che reagiscono con le componenti cellulari in base alla diversa affinità chimica che hanno per esse, dando di conseguenza una reazione tintoria caratteristica e specifica per ognuna che permette di distinguerle.
Blu di metilene, eosina ed azzurro B si trovano in soluzione alcoolica (alcool metilico), dal momento che sono debolmente o affatto solubili in acqua.
Il blu di metilene è un colorante basico e si lega preferibilmente alle strutture acide per interazione ionica (quali i nuclei); l’eosina è invece un colorante acido e serve per aumentare il contrasto di fondo, dal momento che si lega selettivamente al citoplasma cellulare (basico).
L’azzurro B, infine, è una molecola che ha un’affinità specifica per gli acidi nucleici (l’esatta natura dell’azzurro B è coperta da segreto industriale, tuttavia esso si trova ormai nella maggioranza dei preparati commerciali disponibili per la Wright-Giemsa: viene citata in questo articolo per tale ragione, ma ciò non toglie che si possano ottenere buoni risultati anche con preparati che non la contengono).
Grazie all’uso combinato di questi tre coloranti, la tecnica permette di osservare la morfologia e l’organizzazione cellulare nelle sue varie componenti (“effetto differenziale”).
E’ bene sottolineare che, a differenza di altre tecniche microrganismo-selettive, la colorazione di Wright- Giemsa colora tutte le cellule presenti nel campione: sia quelle che fanno parte della normale composizione fisiologica del fluido in esame, sia quelle delle specie parassite eventualmente presenti.
Dopo la colorazione appariranno infatti diversi tipi cellulari di diversi colori: sarà la bravura del microscopista e la sua abilità nel distinguerle in base a forma, dimensioni ed altre caratteristiche fisiche, ciò che permetterà d’identificarle correttamente.
Dal momento che per ragioni storiche e nella letteratura clinica, i risultati fanno riferimento in prevalenza a campioni provenienti da strisci di sangue, anche in quest’articolo assumeremo come riferimento ciò che si osserva in questo caso.
In generale, l’eosina colorerà il citoplasma delle cellule del plasma (monociti, leucociti, etc.) di una tonalità piuttosto uniforme tra il viola ed il cobalto, mentre il blu di metilene ne colorerà i nuclei virando in tonalità accese sul porpora.
I risultati ottenuti dipendono strettamente dal tipo di specie parassita contenuta nel campione: in alcuni casi, essi potrebbero risultare chiaramente distinguibili perchè avranno colori invertiti per nuclei e citoplasma rispetto alle cellule ematiche, a causa della diversificata composizione chimica degli stessi costituenti cellulari.
Alcuni parassiti tipici presentano invece una colorazione loro specifica, quando trattati col metodo Wright Giemsa: in tali casi, il confronto con i risultati tabulati in letteratura medica e l’esperienza del microscopista permetterà d’identificarli con precisione.
Esistono tuttavia casi in cui, come si suol dire, serve occhio, perchè le cellule del microrganismo e quelle endogene del campione possono non risultare così differenziate quanto a reazione ai coloranti o morfologia: per tale motivo questa tecnica deve sempre essere abbinata ad esami clinici ad hoc e non è da considerarsi risolutiva in senso stretto nel formulare una diagnosi.
Materiale occorrente
- una boccetta, munita di contagocce, contenente acqua distillata;
- un vetrino per microscopio;
- preparato per “Wright Giemsa stain” in soluzione alcoolica (alcool metilico): in commercio se ne trovano di vari tipi, tutti ugualmente validi;
- olio per immersione specifico per microscopia;
- un vetrino coprioggetti.
Procedimento
- Strisciare il campione da analizzare sul vetrino per microscopio e lasciar asciugare all’aria: in questa colorazione non si utilizza mai la fissazione al calore;
- Con l’ausilio di un contagocce, porre sullo striscio una quantità di preparato per Wright Giemsa stain sufficiente a ricoprirlo completamente: in questa fase occorre contare attentamente quante gocce di colorante vengono utilizzate, perchè ciò servirà nel passaggio successivo. Lasciar agire per 3 minuti;
- Senza togliere il colorante, aggiungere acqua distillata nella stessa quantità di quest’ultimo e lasciar agire per il doppio del tempo precedente (6 minuti);
- Effettuare il lavaggio del vetrino con acqua distillata, quindi far asciugare per bene all’aria;
- Quando il preparato non apparirà più bagnato, depositare alcune gocce di olio per immersione e attendere 10 minuti;
- Coprire col vetrino porta oggetti.
Il campione è ora pronto per essere osservato al microscopio ottico.
Osservazione del vetrino
Per sfruttare al meglio la risoluzione garantita da questa tecnica, si consiglia d’effettuare l’osservazione direttamente dall’obiettivo a 100x (Fig.1).
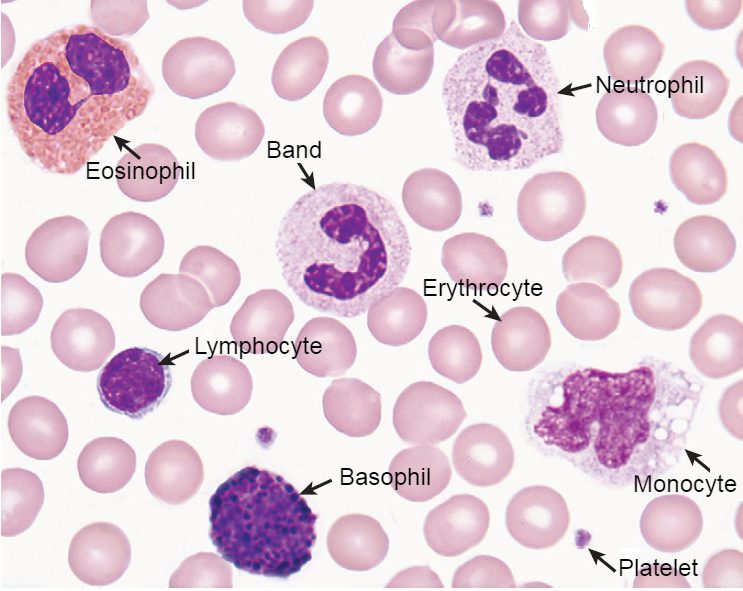
Figura 1 – Uno striscio di sangue senza patogeni colorato con Wright-Giemsa: non ci soffermeremo in questa sede sull’analisi dettagliata di come appaiono le diverse cellule ematiche, dando per scontato ciò sia background del lettore. Quello su cui invece si porrà l’accento è che tutto quello che potrebbe risultare fuori luogo in questo contesto, qualunque forma cellulare anomala nel colore tipico o nell’aspetto, deve subito indurre il microscopista ad approfondire la sua indagine.
Lungi dal voler esaurire l’intera e complessa casistica dei possibili risultati, si mostreranno di seguito quelli per alcuni dei parassiti più comuni.
La ricerca in striscio di sangue dei parassiti del genere Trypanosoma è senza dubbio la più semplice: la caratteristica morfologia di questo protozoo si distanzia infatti nettamente da quella di tutte le altre cellule della componente plasmatica (Fig. 2).
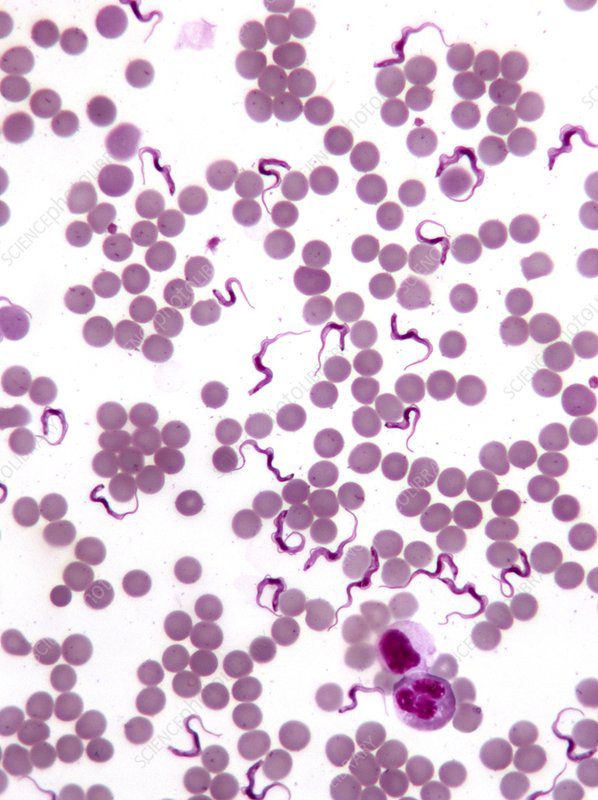
Figura 2 – Tripanosoma è facilmente riconoscibile dalla sua forma affusolata e lunga, quasi nastriforme, ben diversa da quella tondeggiante degli eritrociti e dei leucociti.
Anche l’identificazione di Plasmodium falciparum si presenta del resto relativamente senza difficoltà (Fig. 3).

Figura 3 – Plasmodium falciparum è riconoscibile in questo campione per almeno due ragioni: innanzitutto, presenta una colorazione blu intensa ed una morfologia che lo distingue nettamente da quella degli eritrociti, tondi e quasi rossastri a causa della reazione all’eosina. Inoltre, avendo presente che il suo ciclo vitale si svolge all’interno degli eritrociti stessi, si può notare come alcuni di essi lo contengano al loro interno. Questo è un caso in cui differenze morfologiche e differenze di reazione agli stessi coloranti permettono di differenziare senza ambiguità le cellule nel campione.
Come principio generale, si può dire che avendo ben presente la morfologia e la colorazione specifica delle cellule del sangue, tutto ciò che “stona” col contesto plasma in termini di cito-morfologia e di colore dovrebbe mettere subito in allarme il microscopista allenato.
Poiché nell’articolo si è citato anche l’utilizzo di matrici fecali come uno dei maggiori campi d’applicazione di questa colorazione di Wright-Giemsa, è bene spendere qualche parola anche per campioni di questo tipo.
In genere le feci trattate con la colorazione di Wright-Giemsa presentano colori molto accesi e poche o trascurabili componenti cellulari; la presenza di parassiti in questo caso avviene sempre con gli stessi criteri già visti per gli strisci di sangue, fatto salvo caso particolari (Fig.4).
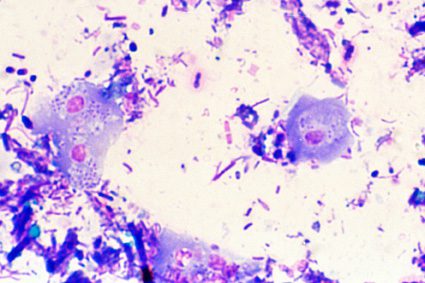
Figura 4 – Due trofozoiti del parassita Dientamoeba fragilis. Questo è un tipico caso in cui è la colorazione invertita a fornire un chiaro discriminante. Diversamente da quanto accade infatti con le cellule endogene, il citoplasma risulta colorato di tonalità scure tra il blu ed il cobalto, mentre i nuclei sono porpora violetti.
Ciò non toglie che alcuni risultati richiedano di consultare la letteratura medica per togliersi ogni dubbio: distinguere tra le forme cellulari possibili a volte può non essere affatto intuitivo (Fig. 5).
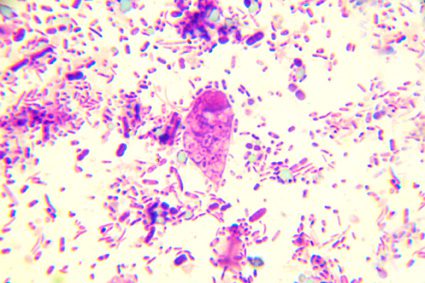
Figura 5 – Al centro dell’immagine, c’è un ovoidale trofozoita di Chilomastix mesnili. E’ più facile di quanto si pensi confonderlo per qualcos’altro, dal momento che non presenta cosi’ grande differenze di colorazione rispetto a ciò che lo circonda. Il rischio di scambiarlo per una semplice cellula epiteliale non è affatto scontato.
Fonti
Sitografia di riferimento
- http://www.atlas-protozoa.com/it/microscope-exam-ed.php
- https://www.emsdiasum.com/microscopy/technical/datasheet/26149.aspx
Sitografia di approfondimento
Per saperne di più sulle pericolose infezioni da Dientamoeba fragilis si rinvia al seguente link:
Informazioni utili sulla “Malattia di Lyme” sono invece consultabili al seguente link:
Sulla natura chimica dell’eosina, uno dei coloranti di maggior utilizzo nella microscopia ottica, in generale:
Sulla struttura chimica del blu di metilene:
https://it.wikipedia.org/wiki/Blu_di_metilene
Crediti per le immagini
Immagine in evidenza:
Figura 1:
Figura 2:
Figura 3:
Figura 4 e figura 5: