Negli ultimi anni è emersa una patologia parassitaria polmonare spesso sottovalutata e sotto diagnosticata, causata da vermi tondi. La strongilosi è una patologia diffusa in tutta Europa (Francia, Spagna, Danimarca, Regno unito, Svizzera, Germania, Grecia ed Italia) che colpisce sia i cani che i gatti, che rappresentano gli ospiti “definitivi” di questo parassita; le volpi in particolare sono considerate un reservoir importante, mentre lupi, coyote e sciacalli rappresentano ulteriori potenziali fonti di infestazione. Nel cane questa infestazione è sostenuta dall’Angiostrongylus vasorum, noto anche come “French Heartworm“.
Caratteristiche
Angiostrongylus vasorum, un nematode facente parte della superfamiglia Metastrongylidea; il suo ciclo vitale è dixenico (Fig.1). Il parassita adulto vive nel ventricolo destro, nell’arteria polmonare e nelle sue diramazioni (come fa la Dirofilaria immitis ); le femmine adulte depongono uova che tramite il sangue arrivano ai capillari polmonari. Qui le uova si schiudono e escono le larve L1, queste entrano nelle pareti vasali e alveolari, le attraversano e con la tosse arrivano in faringe.
Qui vengono deglutite, ingerite e espulse tramite le feci, le quali, a loro volta, vengono ingerite dagli ospiti intermedi obbligati, solitamente gasteropodi appartenenti ai generi Helicella, Succinea, Subulina, Biomphalaria. Negli ospiti intermedi le larve si trasformano in L3, l’ospite finale, cani e volpi, si infesta mangiando il gasteropode contenente le L3. Queste larve entrano nelle pareti del tratto gastrointestinale, migrano attraverso i linfonodi mesenterici fino al fegato e alle arterie polmonari e qui diventano adulti.

Filogenesi
| Regno | Animalia |
|---|---|
| Ramo | Nematoda |
| Classe | Secernentea |
| Ordine | Strongylida |
| Famiglia fantastica | Metastrongyloidea |
| Famiglia | Angiostrongylidae |
| Genere | Angiostrongylus |
| Specie | Angiostrongylus vasorum (Fig.) |
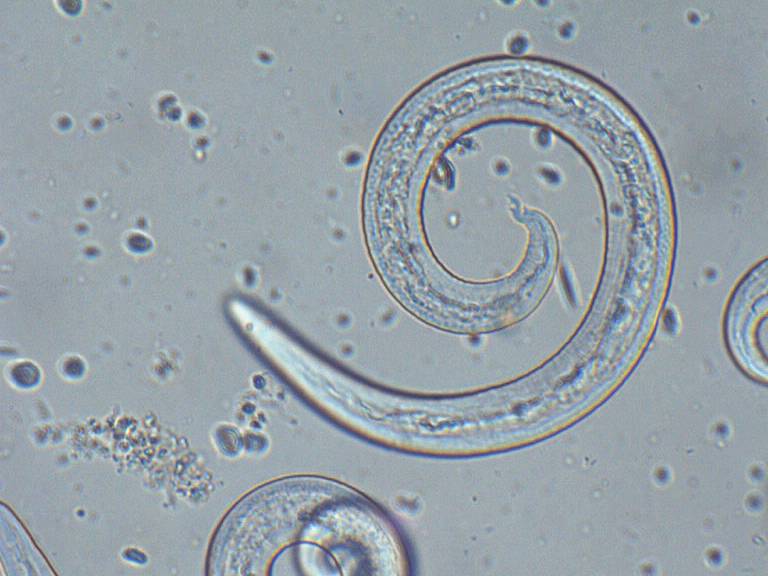
Morfologia strutturale
È un piccolo verme di colore rosato, la sua lunghezza varia da 14 a 20,5 mm e la sua larghezza è da 0,170 a 0,306 mm; le femmine si riconoscono perchè presentano le ovaie bianche, arrotolate attorno all’ intestino. Mentre le larve al primo stadio (L1), attraverso le quali si fa diagnosi, sono lunghe 310-400 um, larghe 14-16 um, presentano un bottone cefalico anteriore, e un estremità caudale appuntita con andamento ricurvo e spina dorsale (Fig.2).
Fonte:researchgate.net
Patogenesi
Le manifestazioni cliniche dell’infestazione da A. vasorum nel cane sono variabili. Esistono casi di infestazione subclinica, ma i segni respiratori, quali tosse e dispnea indotte dalla polmonite verminosa, sono osservati di frequente, associati a disturbi emorragici, neurologici, gastrointestinali o aspecifici. Nelle infestazioni croniche è possibile osservare anoressia, anemia, calo ponderale, depressione, ipertensione polmonare e segni di coagulopatia (ad es. melena, emottisi, sanguinamento prolungato da lesioni minori ed ematomi sottocutanei); in rari casi può verificarsi il decesso improvviso.
Talvolta, le larve e, più raramente, gli stadi adulti di A. vasorum possono raggiungere distretti ectopici quali cervello, vescica, rene o camera anteriore dell’occhio; in questi casi possono essere presenti segni clinici legati alla presenza del parassita in tali organi.
Metodi di identificazione
La diagnosi può avvenire attraverso l’individuazione delle larve di primo stadio in (almeno) 4 grammi di feci fresche, utilizzando il metodo di Baermann. A causa dell’ampia variabilità nell’escrezione delle larve, è preferibile che il campione fecale includa feci raccolte per 3 giorni consecutivi, in alternativa, è possibile effettuare la rilevazione microscopica delle larve di primo stadio nel materiale di lavaggio bronchiale; sono inoltre disponibili dei test sierologici, in particolare un test sierologico commerciale per la rilevazione dell’antigene circolante.
Metodo Baermann
L’apparato di Baerman viene utilizzato per ricercare le larve (L1) dei nematodi (protostrongilidi, dictyocaulidi e metastrongilidi), dotati di mobilità spontanea e spiccata idrofilia; come detto, si può operare su campioni singoli o su pool di feci.
Tecnica:
- preparare pool di 5 campioni (utilizzando 5 g di ciascun campione) e porli direttamente su un rettangolo di garza
- chiudere il rettangolo con filo metallico morbido (da giardinaggio) a formare un sacchetto posizionare nell’imbuto non occludendo il foro di deflussione
- aggiungere acqua tiepida fino a riempire i 3/4 dell’imbuto e lasciare riposare per 24 ore
- aprire la valvola dell’imbuto e far fluire la soluzione fecale fin quasi a riempire una provetta a fondo conico da 10 mL
- centrifugare a 1.000 rpm per 5 minuti, allontanare il surnatante e aggiungere al liquido qualche goccia di soluzione iodica (acqua 100, ioduro di potassio 50, iodio cristalli 10)
- raccogliere l’intero sedimento colorato con una pipetta ponendolo su un vetrino portaoggetti
Terapia
La terapia antielmintica prevede l’uso di prodotti a base di lattoni macrociclici con vari protocolli di trattamento o la somministrazione quotidiana ripetuta di antielmintici a base di benzimidazolici ( ad es. fenbendazolo alla dose di 25-50 mg\KG per os per 3 settimane). Nei casi clinici gravi potrebbe essere necessario ricorrere a un trattamento di supporto con antibiotici, glucocorticoidi e terapia reidratante; durante il trattamento l’animale deve essere tenuto a riposo (almeno 2-3 giorni).
Fonti
- Angiostrongylus vasorum – frwiki.wiki
- Strongili polmonari nel gatto: cosa sono e come si curano? (clinicaveterinariaprimavera.it)
- 06l53eqn_1147_ESCCAP_GL1__Italian_v4_1p.pdf (Linee Guida originali ESCCAP 1 Seconda Edizione – Settembre 2010 © ESCCAP 2018)
- D. TRAVERSA, L. VENCO; Parassitologia clinica del cane e del gatto; PVI, 2018
- Figura 3: Morphology of the first stage larva of Angiostrongylus vasorum. First… | Download Scientific Diagram (researchgate.net)
- Figura 2: Angiostrongylus vasorum – Wikipedia
- Figura 1: Life cycle of Angiostrongylus vasorum (with courtsey of Bayer animal… | Download Scientific Diagram (researchgate.net)
- Immagine in evidenza: Angiostrongylus vasorum: an update | The Veterinary Nurse