Il Plasmodium vivax è il parassita responsabile della cosiddetta malaria terzana benigna.
Caratteristiche generali
Il Plasmodium vivax è un protozoo parassita intracellulare obbligato, necessita di un ospite vertebrato (l’uomo) e di un ospite invertebrato (la zanzara Anopheles, che ne è anche il vettore). Il Plasmodium vivax è la specie responsabile della malaria più diffusa al mondo. Infatti è presente anche in aree a clima più temperato rispetto a Plasmodium falciparum, e causa circa il 72% dei casi di malaria nel Sudest asiatico e nelle Americhe. Anche se le infezioni che provoca sono meno virulente e il decorso della malattia meno grave rispetto a P. falciparum, P. vivax può rimanere dormiente nel fegato umano provocando recidive.
Filogenesi
| Dominio | Eukariota |
| Regno | Protista |
| Sottoregno | Chromalveolata |
| Phylum | Apicomplexa |
| Classe | Aconoidasida |
| Ordine | Haemosporida |
| Famiglia | Plasmodiidae |
| Genere | Plasmodium |
| Specie | vivax |
Ciclo vitale
Il Plasmodium vivax si moltiplica asessualmente (ciclo “schizogonico”) nell’uomo e sessualmente (ciclo “sporogonico”) nella zanzara (Figura 1).
Il ciclo inizia con gli sporozoiti inoculati dalla zanzara che invadono primariamente il fegato. Successivamente, i parassiti infettano gli eritrociti iniziando il ciclo schizogonico che porta alla formazione dei gametociti. Questi ultimi vengono ingeriti dalla zanzara, e nello stomaco dell’insetto si generano i gameti. Questi poi si fondono a formare lo zigote, che diventa poi oochinete. Successivamente l’oochinete penetra la parete dello stomaco dell’insetto, dove poi matura in oociste. Infine nelle oocisti nascono gli sporozoiti, che invadono le ghiandole salivari della zanzara. Il ciclo ricomincia in un nuovo ospite umano quando la zanzara con gli sporozoiti lo punge.
Il Plasmodium vivax nell’uomo produce un altro stadio di sviluppo, l’ipnozoita. Gli ipnozoiti rimangono dormienti nel fegato, ma si possono riattivare a distanza di mesi o anni dando origine a un nuovo ciclo schizogonico.

Morfologia strutturale
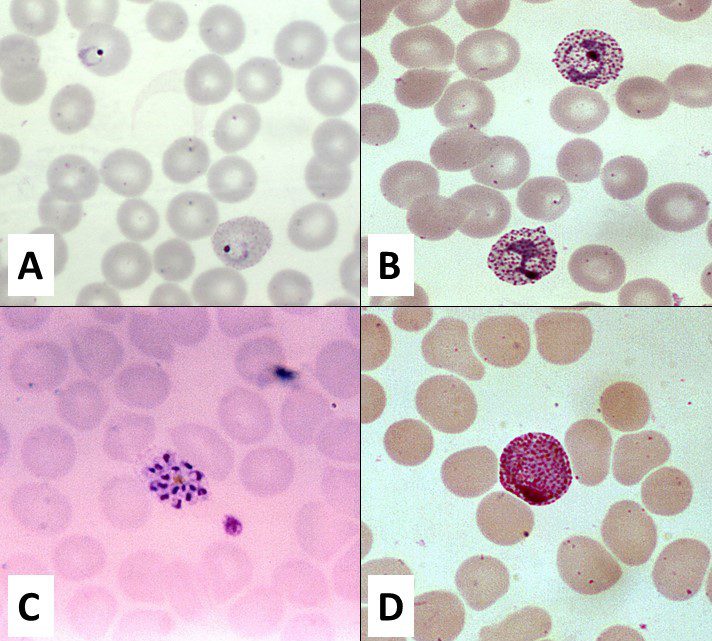
Plasmodium vivax attraversa quattro stadi di sviluppo nel ciclo eritrocitario nell’uomo (Figura 2). Questi includono:
- L’anello, con un grosso nucleo, mostra un citoplasma che tende ad apparire frammentato durante la maturazione.
- Il trofozoita, quando è maturo mostra un citoplasma ameboide. Inoltre, sulla superficie dell’eritrocita possono comparire granulazioni (chiamate granulazioni di Shuffner).
- Lo schizonte, contiene da 12 a 24 merozoiti e mostra un pigmento malarico concentrato.
- Il gametocita, di forma tondeggiante, occupa solitamente l’intero volume dell’eritrocita. Nei gametociti il pigmento malarico è diffuso.
Gli stadi di oociste e gli sporozoiti che si sviluppano nella zanzara hanno le stesse caratteristiche degli altri plasmodi della malaria (Figura 3).
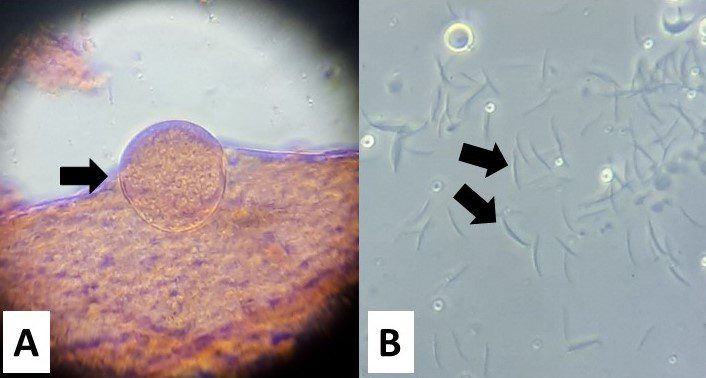
Patogenesi
Dal punto di vista clinico Plasmodium vivax provoca la malaria terzana benigna. I sintomi della malaria solitamente includono mal di testa, mialgie, diarrea, vomito, eccessiva sudorazione e brividi. I picchi di febbre (parossismo malarico) si verificano approssimativamente ogni 48 ore (febbre terzana). I picchi di febbre sono provocati dalla rottura dei globuli rossi e il conseguente rilascio dei parassiti e dei loro cataboliti.
Le infezioni da Plasmodium vivax tendono a essere meno gravi rispetto a quelle causate da P. falciparum. Tuttavia, in alcuni casi sono state riportate complicazioni tra cui la sindrome da distress respiratorio (Ards), l’edema polmonare e la disfuzione multiorgano.
Metodi di identificazione
La diagnosi si basa prevalentemente sull’osservazione microscopica del parassita in strisci di sangue sottili o a goccia spessa, colorati con il metodo di Wright-Giemsa. Tuttavia, la colorazione di Giemsa è consigliata per evidenziare meglio le granulazioni di Shuffner.
Le caratteristiche diagnostiche più importanti del Plasmodium vivax sono:
- Gli eritrociti infetti che sono spesso più grandi rispetto agli altri
- Le infezioni multiple che sono rare
- Il citoplasma dei trofozoiti che è ameboide
- La presenza delle granulazioni di Shuffner
- Gli schizonti che sono comuni nel sangue periferico
- I gametociti che sono tondeggianti
Alternativamente, la diagnosi di Plasmodium vivax può essere raggiunta con:
- I test immunocromatografici rapidi per rilevare gli antigeni (proteina ricca in istidina 2) o gli enzimi del parassita (lattato deidrogenasi). La loro sensibilità è paragonabile all’esame microscopico degli strisci di sangue.
- La diagnosi tramite PCR.
- I test sierologici che rilevano solo l’esposizione pregressa al parassita ma non consentono di diagnosticare un’infezione in corso.
Terapia
I trattamenti vanno distinti a seconda della gravità dell’infezione e della presenza di parassiti clorochina-resistenti.
Le infezioni non complicate possono essere trattate con:
- Chinina solfato con doxiciclina o tetraciclina, o atovaquone/proguanil, se si hanno sospetti di clorochina-resistenza (in Papua Nuova Guinea e Indonesia).
- Clorochina/idrossiclorochina solfato se il parassita è clorochina-sensibile (al di fuori di Papua Nuova Guinea e Indonesia).
Per le infezioni gravi è necessario l’uso di artesunato EV, seguito da uno dei seguenti: artemetere/lumefantrina, atovaquone/proguanil, doxiciclina, o clindamicina (nelle donne in gravidanza).
Infine, l’uso di primachina o tafenochina è necessario per debellare gli ipnozoiti nel fegato.
Prevenzione
La prevenzione per i viaggiatori in aree endemiche si basa sulla protezione dai morsi delle zanzare Anopheles (uso di zanzariere e repellenti) e sulla chemioprofilassi. La scelta dei farmaci da usare nella chemioprofilassi dipende in larga parte dal tipo di viaggio, dal tempo di permanenza e dal Paese visitato.