Caratteristiche
L’acondroplasia (ACH) è una malattia genetica caratterizzata dalla presenza di nanismo (o bassa statura) associata ad una serie di malformazioni aggiunte a seguito di un’interruzione dello sviluppo della cartilagine delle epifisi. Nello specifico, si tratta di una malattia autosomica dominante che ha come tratti tipici arti corti rispetto al tronco, tronco lungo e stretto, macrocefalia con fronte prominente e ipoplasia mediofacciale con radice nasale infossata. L’aspettativa di vita è in genere paragonabile a quella del resto della popolazione, oppure leggermente inferiore perché si presenta un aumento del rischio di mortalità ricollegabile, per lo più, a problemi cardiovascolari secondari.
L’acondroplasia è data da mutazioni del gene FGFR3. Il confronto tra FGFR3 wild type e mutante ha mostrato che i recettori mutanti avevano un aumento del pathway di segnalazione che potrebbe essere ulteriormente potenziato in presenza di ligandi del fattore di crescita dei fibroblasti (FGF). Sulla base di queste conoscenze, sono state identificate molecole di segnalazione e vie che interagiscono con FGFR3 e che potrebbero essere sfruttate per contrastare gli effetti di FGFR3 iperattivato.
In questo articolo scopriremo le caratteristiche più importanti che portano al “nanismo acondroplasico”.
Eziologia e patogenesi
L’acondroplasia è causata da alterazioni a carico del gene FGFR3, codificante per una molecola espressa nella cartilagine in accrescimento. In particolare, il gene mappa sul braccio corto del cromosoma 4 in posizione 4p16.3 e contiene l’informazione per fabbricare una proteina definita come il “recettore del fattore di crescita dei fibroblasti di tipo 3”. Questo recettore rende le cellule capaci di “accogliere” una molecola segnale che le stimola a moltiplicarsi.
Quando è presente la mutazione, si avrà un’iperattivazione di FGFR3 con conseguente inibizione dell’ossificazione encodrale, fondamentale per la crescita ossea. Si avranno, pertanto, ripercussioni a carico di tutte le strutture scheletriche, con maggior coinvolgimento delle ossa lunghe. Il pathway biologico prevede che, nei pazienti con ACH, la mutazione più frequente sia la G380R, localizzata nel dominio transmembrana di FGFR3; ciò comporta una stimolazione prolungata del recettore e quindi si parla di mutazione “gain of function“.
L’acondroplasia si trasmette con pattern autosomico dominante: questo vuol dire che la malattia è causata da mutazioni in una sola delle due copie del gene. Pertanto due genitori, di cui uno soltanto affetto da ACH, hanno il 50% di probabilità di avere un figlio affetto; inoltre, non esistono portatori sani di acondroplasia. Perché la probabilità di eredità genetica che il bambino ne soffra è del 50%, se entrambi i genitori sono affetti, la probabilità sale al 75% del totale.
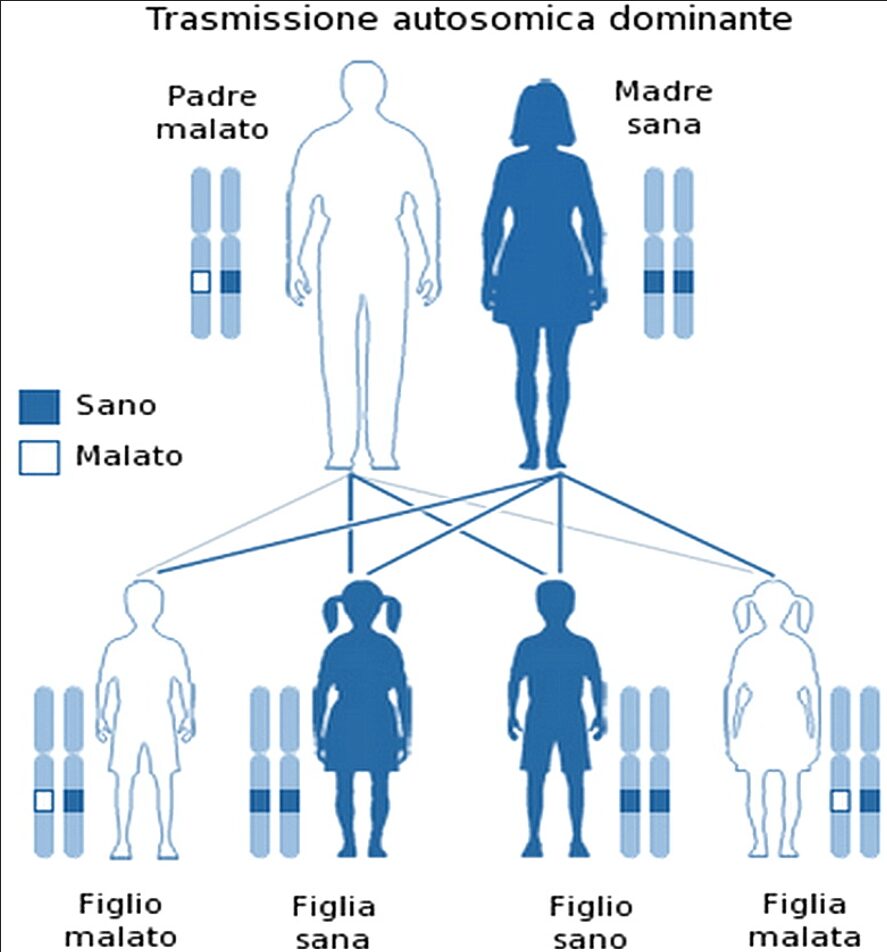
È importante sottolineare che, nella maggior parte dei casi (oltre il 95%), i genitori di figli affetti sono sani. Quindi, nel bambino compaiono mutazioni spontanee sul cromosoma che portano alla malattia espressione. In questi casi si parla di mutazioni de novo.
Segni e sintomi
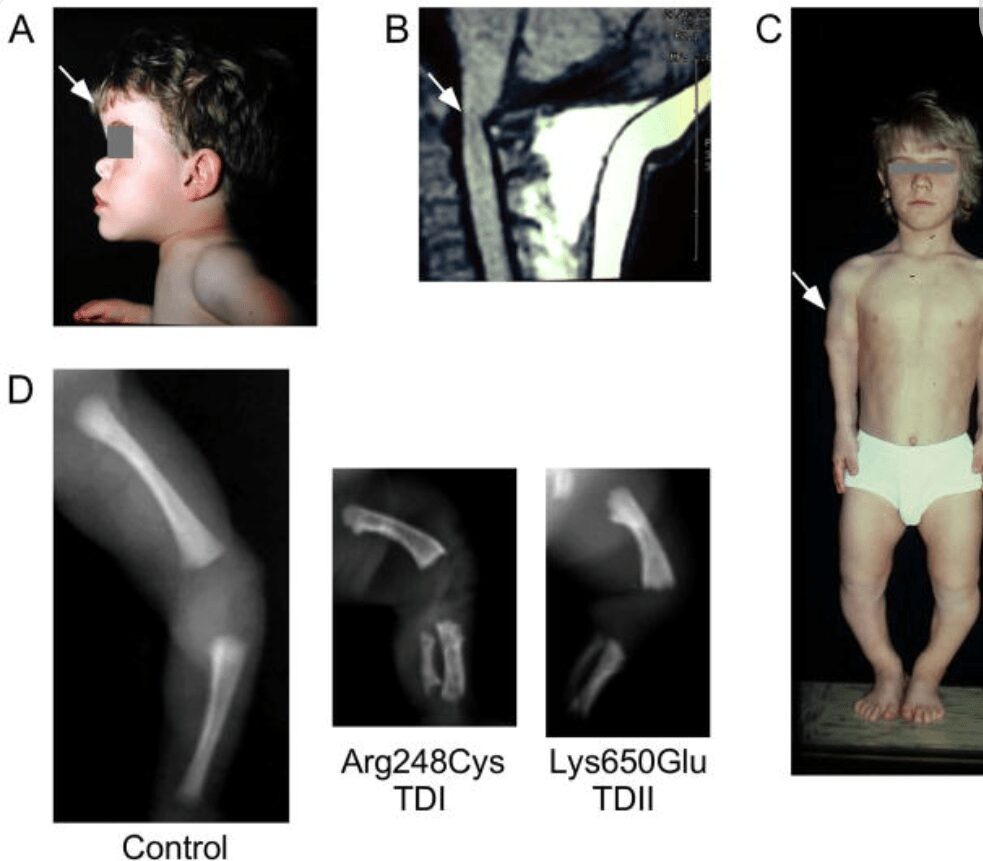
Il quadro clinico dell’acondroplasia è piuttosto chiaro sin dalla nascita. È caratterizzato da lunghezza media alla nascita intorno a 47 cm e peso nella norma e, già dai primi mesi, i bambini presentano arti corti rispetto al tronco con prevalente riduzione di lunghezza delle braccia e delle cosce rispetto alla lunghezza degli avambracci e delle gambe. Successivamente il quadro clinico si rende via via più manifesto con macrocefalia, bozze frontali prominenti e profilo del viso piatto, naso insellato, limitata estensione del gomito, cifosi toraco-lombare e iperlassità articolare.
FGFR3 [https://www.ncbi.nlm.nih.gov/]
L’altezza media degli adulti è di circa 130 cm nei maschi e 125 cm nelle femmine. La maggior parte dei soggetti affetti hanno una vita autonoma seppur, in casi sporadici, vengono segnalati ritardi nello sviluppo psico-intellettivo. Con l’età, i pazienti ACH sviluppano un’eccessiva lordosi lombare. Una complicanza importante, il restringimento del canale spinale dovuto a alterazioni degenerative del canale spinale, può portare alla compressione della radice nervosa e spesso richiede una decompressione chirurgica.
Epidemiologia
Dai dati epidemiologici emerge che l’incidenza mondiale per l’acondroplasia è di circa 1/25.000 nati vivi. L’80% dei casi è sporadico. In Italia la prevalenza è stimata fra 1/26.000 – 1/27.000.
Diagnosi
La diagnosi di ACH si basa, il più delle volte, su caratteristiche cliniche e su osservazioni radiologiche; un’ulteriore conferma può venire dall’analisi genetica, con ricerca di mutazioni nel gene FGFR3. In particolare, lo studio genetico di questa malattia è dato dallo studio di campioni cellulari ottenuti mediante amniocentesi o biopsia del corion.
Terapia
La prognosi per i pazienti acondroplasici è buona, anche se si stima che sia mediamente inferiore di una decina di anni rispetto al resto della popolazione, principalmente per il rischio di complicanze neurologiche legate alla riduzione del canale vertebrale e per l’aumentato tasso di patologie cardiovascolari. Fino a pochissimo tempo fa, le uniche opzioni terapeutiche possibili erano supporto fisioterapico e/o interventi ortopedici – anche di tipo chirurgico – per migliorare alcune condizioni dei pazienti. Al momento non sono disponibili trattamenti curativi per questa malattia.
Negli ultimi anni, sulla base del meccanismo patogenetico, sono stati ipotizzati diversi potenziali approcci terapeutici basati sul blocco dell’iper-attivazione di FGFR3. Un possibile esempio è dato da uno studio del 2014 dove è stato studiato l’effetto delle statine sulla crescita dell’osso in topi transgenici mutati in FGFR3, sfruttando l’effetto anabolizzante degli steroidi sui condrociti. In vivo la somministrazione di statine al topo provoca un parziale allungamento dell’osso, ma non sono disponibili evidenze riguardo la sicurezza del suo utilizzo nell’uomo.
Fonti
- Ornitz DM, Legeai-Mallet L. Achondroplasia: Development, pathogenesis, and therapy. Dev Dyn. 2017 Apr;246(4):291-309. doi: 10.1002/dvdy.24479. Epub 2017 Mar 2. PMID: 27987249; PMCID: PMC5354942.
- https://www.orpha.net/consor/cgi-bin/OC_Exp.php?Lng=IT&Expert=15
- https://www.malattierare.eu/pages/rivista/Acondroplasia-e-se-fossimo-ad-un-passo-dal-cambiarne-la-storia-naturale-idA98
- https://www.ospedalebambinogesu.it/acondroplasia-79918/
- https://www.telethon.it/cosa-facciamo/ricerca/malattie-studiate/acondroplasia/