Utilizzo
Il Mueller Hinton Agar è il terreno standardizzato per la procedura di diffusione su dischetto (Figura 1) per valutare la sensibilità agli agenti antimicrobici dei microrganismi aerobi, a crescita rapida, isolati in ambito clinico. Questo terreno è conforme alle direttive del Clinical and Laboratory Standards Institute (CLSI) e dello European Committee on Antimicrobial Susceptibility Testing (EUCAST).
Questo test è particolarmente utile in ambito clinico, appunto, per valutare caso per caso la sensibilità degli isolati clinici dai singoli pazienti agli antibiotici, in modo da mettere a punto il piano terapeutico più adeguato.

Storia ed evoluzione del metodo
Il Mueller Hinton Agar venne ideato inizialmente nel 1941 dagli omonimi Mueller e Hinton nel 1941 per l’isolamento dei gonococchi e dei meningococchi. Venne poi ripreso da Kirby, negli anni Sessanta, per rispondere alle esigenze dettate dalle necessità cliniche di identificare rapidamente la sensibilità di un microrganismo ai possibili antibiotici da utilizzare nelle terapie.
Il metodo venne ottimizzato poi da Bauer e dallo stesso Kirby, grazie ad uno studio collaborativo internazionale. Da allora, il metodo della disco-diffusione su Mueller Hinton Agar si è confermato come il test più affidabile per eseguire un antibiogramma. L’Istituto CLSI per gli USA e il comitato EUCAST per l’Europa sono responsabili dell’aggiornamento e della modifica della procedura originale, attraverso un processo di consenso globale.
Nei documenti pubblicati dai due istituti sono incluse anche le linee guida interpretative per le zone di inibizione. Il terreno è adatto a testare la maggior parte dei patogeni, compresi i più comuni batteri aerobi a crescita rapida, tra cui Enterobacteriaceae, Pseudomonas spp., Acinetobacter spp., Staphylococcus spp., Aeromonas e Burkolderia pseudomallei.
Composizione del terreno
Il terreno Mueller Hinton Agar standard è così composto:
- Estratto di carne 2.0 g/L
- Digerito acido di caseina 17.5 g/L
- Amido 1.5 g/L
- Agar 17.0 g/L
Il terreno viene venduto in forma polverosa, con una granulometria fine, omogenea e di colore beige. In soluzione e in piastra, il terreno assume un colore limpido e leggermente opalescente, di colore giallo paglierino.
Il pH finale del terreno è pari a 7.3, a 20-25°C.
Preparazione del terreno
Per la preparazione di piastre Petri con il Mueller Hinton Agar, si procede sospendendo 38g di polvere (con la composizione sopra riportata) in acqua purificata fredda. Si porta ad ebollizione sotto agitazione e ai autoclava a 121°C per 15 minuti.
Una volta raffreddato a 47-55°C si procede con il trasferimento nelle piastre Petri, versando 25 ml per piastra. Prima di utilizzare le piastre, è necessario che la superficie sia asciutta, ma non in maniera eccessiva.
Procedura per il test di sensibilità
In sintesi, il test prevede la disposizione di dischi imbibiti di antibiotico sulla superficie di una piastra inoculata con l’isolato clinico. La formazione di un alone intorno ad uno o più dischi è indice della sensibilità dell’isolato a quell’antibiotico. Il diametro dell’alone formatosi intorno al disco viene misurato e confrontato con dei valori standard per determinare la sensibilità del microrganismo (Figura 2).

Di seguito si riportano i punti principali della procedura di lavoro descritta nelle linee guida EUCAST:
- Prelevare diverse colonie dell’isolato clinico coltivato su terreno non selettivo, mediante un’ansa o un tampone;
- Sospendere le colonie in soluzione fisiologica sterile fino ad ottenere un’opacità pari a 0.5 OD. Questa sospensione deve essere utilizzata entro 60 minuti dalla preparazione;
- Immergere un tampone di cotone nella sospensione. Per i batteri Gram negativi, spremere il tampone sulle pareti della provetta per evitare un eccesso di inoculo; per i batteri Gram positivi non è consigliabile eliminare l’eccesso;
- Con il tampone di cotone, inoculare la piastra di Mueller Hinton facendo uso di un inoculatore rotante oppure strisciando manualmente su tutta la piastra;
- Entro 15 minuti dalla semina delle piastre posizionare i dischi con antibiotici (fino a 6 per piastra); una volta depositati i dischi non devono essere spostati o rimossi;
- Entro 15 minuti dalla deposizione dei dischi, capovolgere le piastre assicurandosi che i dischetti non cadano e trasferire in termostato;
- Incubare a 35 °C in aerobiosi per 16-20 ore, 24 ore per glicopeptidi/Enterococcus.
Risultati della crescita
Dopo l’incubazione, per interpretare i risultati del test si procede con l’osservazione della crescita dei microrganismi sulla superficie della piastra. La crescita deve essere uniforme e senza aree di interruzione, senza colonie isolate e i bordi degli aloni di inibizione non devono essere frastagliati. Nel caso in cui la crescita non dovesse essere confluente, il test deve essere ripetuto.
Secondo il CLSI, per misurare la suscettibilità di un ceppo si può procedere misurando ad occhio nudo il diametro delle zone di totale inibizione , incluso il diametro del dischetto e arrotondare al millimetro utilizzando un calibro a corsoio. Il dispositivo di misura è posto alla base della piastra capovolta su un fondo nero non riflettente e illuminato dall’alto (Figura 3).

Le linee guida per l’interpretazione dei risultati sono periodicamente aggiornate e pubblicate dall’apposita Commissione del CLSI. Sono pubbliche e consultabili dai laboratori di analisi cliniche, i quali sono tenuti ad allinearsi alle linee guida sia per quanto riguarda il metodo sia in relazione ai criteri interpretativi. L’istituto fornisce dei criteri specifici per ciascun genere/specie di microrganismi responsabili delle infezioni cliniche rilevanti. Di seguito si riporta, come esempio, la tabella con i criteri per determinare la sensibilità di Pseudomonas aeruginosa agli antibiotici beta-lattamici (Figura 4).

Tutti i criteri interpretativi, specifici per ciascuna specie batterica/genere di patogeni è consultabile al sito dell’Istituto CLSI. Clicca sul link in basso per saperne di più!
Immagini
Di seguito, si riportano alcune immagini di piastre di Mueller Hinton Agar sulle quali è stato eseguito il test di sensibilità per disco-diffusione.
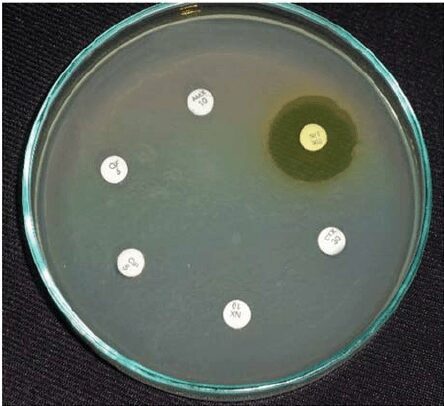
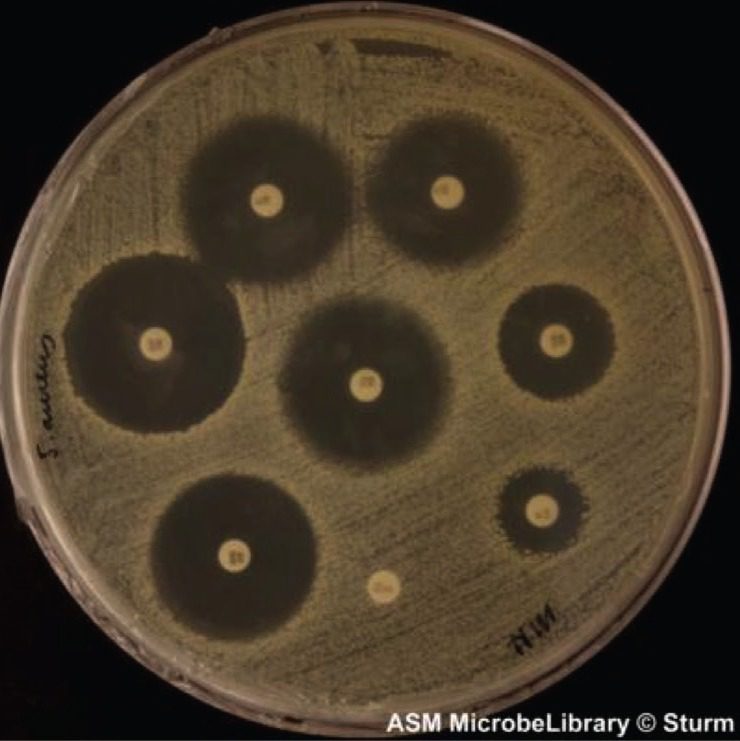

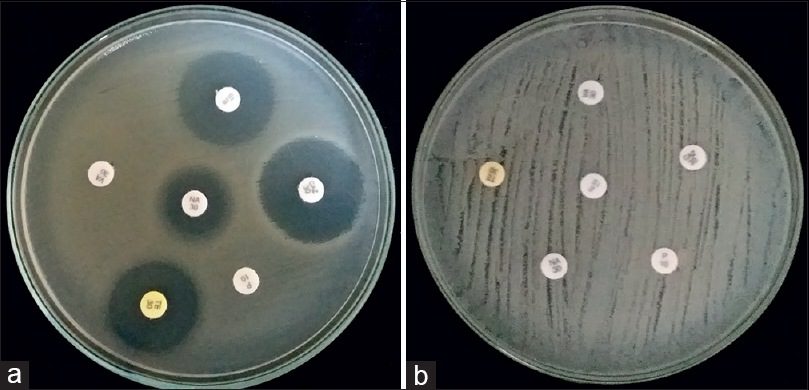
Limitazioni del terreno
L’Agar Mueller Hinton è il terreno abitualmente utilizzato per i test di sensibilità di aerobi a crescita rapida o anaerobi facoltativi, come stafilococchi, enterococchi, famiglia Enterobacteriaceae e Gram-negativi aerobi (Pseudomonas spp.).
Per le analisi delle specie esigenti, come Haemophlius spp., Neisseria spp., e streptococchi si applicano invece tecniche, terreni e condizioni differenti.
La procedura standardizzata del CLSI e dell’EUCAST non viene applicata nelle analisi su anaerobi obbligati, organismi che mostrano crescita insufficiente o lenta su agar Mueller Hinton o batteri con spiccate variazioni di crescita tra i singoli ceppi. Gli organismi esigenti, come Haemophilus influenzae, devono essere analizzati secondo le raccomandazioni del CLSI e delll’EUCAST.
Fonti
- Shresta et al (2012) Multi Drug Resistant Pathogens Causing Urinary Tract Infection in Children at Kathmandu Model Hospital. Journal of Nepal Paediatric Society
- Tasha L. Sturm. 2009. Kirby-Bauer disk diffusion susceptibility test. Visual Resources. American Society for Microbiology, Washington, DC. www.microbelibrary.org
- https://www.bd.com/resource.aspx?IDX=8909
- https://clsi.org/