Signori e signore, benvenuti alla competizione del Western Blotting. Tutto è pronto qui dai nostri laboratori, gli atleti, le proteine, si stanno scaldando ai blocchi di partenza, concentrati come non mai per questa importantissima gara di corsa che decreterà le sorti del miglior fosforilato del 2020. Ed ecco poi, che al fotofinish ci sono i nostri anticorpi, pronti ad impressionare l’istante migliore al momento dell’arrivo. Il pubblico freme, la giornata è favorevole, è l’ora di iniziare.
Avremo potuto iniziare questo articolo semplicemente descrivendo il western blotting come una tecnica di laboratorio, molto utilizzata, atta ad identificare proteine di interesse in una miscela tramite la reazione antigene/anticorpo, ma perché non usare un po’ di immaginazione? Chiudete perciò gli occhi e immaginate di far parte di questa competizione, immaginate di essere i preparatori atletici dei campioni in gara e siate sicuri che come spesso accade nella scienza, tutto sarà molto più divertente e chiaro.
L’immaginazione vi porterà OVUNQUE, disse “qualcuno”.
Principio del western blotting
Il principio del western blotting (o Immunoblotting o Immunofissazione) si basa sull’identificazione, con un anticorpo specifico, di un determinato antigene (proteina) presente all’interno di una complessa miscela di antigeni (o proteine) separate in un gel di poliacrilammide in base al peso molecolare e immobilizzate su una membrana. Questo permette di monitorare ad esempio l’espressione proteica in una cellula e quindi di determinare la presenza, la quantità e il peso molecolare di uno specifico target.
Chi almeno una volta si è trovato alle prese con il western blotting saprà che è caratterizzato da un procedimento multistep. Queste varie fasi, oltre ad aumentare il tempo di svolgimento dell’esperimento, aumentano anche la probabilità di errore e ne riducono il tasso di riproducibilità. Proprio per queste ed altre motivazioni, la ricerca scientifica si sta muovendo per cercare di apportare migliorie che possano aumentarne l’efficienza.
Insomma, la competizione sarà bella lunga da seguire e necessiterà di estrema concentrazione, ma dopo tutto sono i vostri “atleti”.
Metodo
Come ogni gara che si rispetti, ci sono delle severe regole (fasi) a cui atleti e preparatori stessi devono severamente attenersi per poter partecipare in maniera consona e soprattutto per poter conseguire buoni risultati.
Le molteplici fasi del western blotting (Fig. 3) sono:
1. Preparazione del campione
Per poter accedere alla gara, il nostro campione deve essere sottoposto ad un severo allenamento. Tradotto nel linguaggio biologico, i nostri campioni devono essere preparati in modo tale da poter passare agli step successivi. A livello pratico questo si esplica in:
- Lisi del campione: alle cellule viene aggiunta una soluzione di lisi. In questo modo si andranno a degradare le componenti cellulari (di cui non abbiamo bisogno) e si manterrà l’integrità delle proteine. Per favorire un miglior risultato, questa fase, può essere favorita da incubazioni ad alte temperature (es: 95 °C) o sonicazione.
- Isolamento delle proteine: una volta avvenuta la lisi, i campioni vengono centrifugati a massima potenza. La centrifugazione è un passaggio importante, in quanto permette una più semplice separazione tra le proteine (surnatante), che essendo più leggere rimarranno in alto, e debris cellulare (pellet) che si andrà, a causa del suo peso maggiore, a disporre sul fondo della nostra provetta. Basta quindi aspirare il surnatante (miscela di proteine) ed il pellet invece buttato.
- Dosaggio delle proteine: per effettuare una corsa più efficiente e più semplice da interpretare, è necessario che tutti i campioni di partenza contengano la stessa concentrazione di proteine. Tramite il dosaggio di proteine si identifica quindi il volume di ogni campione da caricare nel gel.
Infine, basandosi sul volume finale del campione, vengono aggiunti un riducente (B-mercaptoetanolo) ed un tracciante (Blu di Bromofenolo). A questo punto i nostri campioni sono pronti per il fischio di inizio della corsa.
2. SDS- PHAGE o Elettroforesi su gel di poliacrilammide
Come sappiamo, gli atleti non sono tutti uguali. Le proteine, a differenza di ciò che accade per l’elettroforesi del DNA, in cui la molecola di sua natura possiede carica negativa, possono possedere carica netta differente in base alla loro struttura molecolare.
Per questo motivo, nel western blotting viene effettuata L’elettroforesi su gel di poliacrilammide con sodio-dodecil-solfato (SDS-PAGE). Tramite questa tecnica, la separazione elettroforetica delle proteine avviene in condizioni denaturanti e la presenza dell’SDS, un detergente anionico (con carica negativa), annulla la carica propria delle proteine e le carica tutte negativamente: le proteine avranno tutte carica negativa netta e migreranno verso il polo positivo; la velocità di migrazione delle singole proteine dipenderà così solo dal loro peso molecolare.
Preparazione del Gel
Ogni gel è costituito da due parti:
Running o Resolving: parte inferiore, costituita da una percentuale di acrilammide maggiore (ES: 10-15%), con la funzione di separare le proteine in base al loro peso molecolare (è dove avviene la corsa vera e propria), un po’ come fosse la pista della competizione.
Stacking: parte superiore del gel, dove alloggiano i pozzetti di caricamento dei campioni, costituito da una concentrazione minore di acrilammide (4-6%). La sua funzione è quella di concentrare il campione proteico caricato nei pozzetti, in modo tale che tutte le proteine presenti nella miscela inizino la loro corsa dallo stesso punto di partenza, un po’ come se fosse caratterizzato dai blocchi di partenza.
Stacking gel e Resolving gel hanno gli stessi ingredienti ma in quantità diverse, un pH diverso ed una concentrazione di acrilammide (AA) diversa. Quest’ultima determina la grandezza delle maglie del gel: maggiore sarà la concentrazione, minori saranno le dimensioni dei pori del gel, più efficiente sarà la separazione delle macromolecole.
Caricamento e corsa
Il gel viene posto su un supporto per l’elettroforesi, i campioni vengono caricati all’interno degli appositi pozzetti nello stacking gel, insieme ad un marker e successivamente si imposta la corsa. Il tempo e la velocità di essa dipendono dall’esperimento e dalla taglia della proteina target che vogliamo identificare.
3. Blotting
Una volta avvenuta la corsa, le proteine devono essere trasferite su membrana per renderle accessibili alle fasi successive, ovvero il riconoscimento dell’anticorpo. Le membrane più utilizzate per il western blotting sono quelle di nitrocellulosa o PVDF. Le PVDF sono costituite da un materiale differente da quelle di nitrocellulosa e per questo motivo resistono meglio allo stripping (vedi dopo) ed a differenza delle altre, prima dell’utilizzo devono essere attivate mediante incubazione di circa 1 minuto in metanolo.
Per permettere il trasferimento:
- Preparazione del sandwhich: il gel viene posto all’interno di un sandwich così costituito: fogli assorbenti imbevuti in buffer di blottaggio, membrana di nitro o PVDF, gel, altri foglietti imbevuti.
- Blottaggio: Il sandwich viene posto all’interno di uno strumento (electroblotter) in grado di determinare un campo elettrico ortogonale al gel. In questo modo, le proteine si sposteranno dal gel alla membrana sottostante dove rimarranno immobilizzate.
4. Saturazione
Sulla nostra membrana ora saranno presenti, tutte le proteine dei nostri campioni, oltre quella di nostro interesse. Per favorire il riconoscimento specifico antigene-anticorpo e bloccare i siti aspecifici di legame, si procede a saturare la membrana con soluzioni proteiche. Le più utilizzate sono il Non Fat Milk (NFM) e Bovine Serum Albumin (BSA). Durante questa fase le membrane vengono poste su una contenitore e messe in bascula, il tempo di saturazione è di circa 1h.
5. Lavaggio ed incubazione con anticorpo primario
Dopo la fase 4) le membrane vengono lavate con una soluzione di TBS-T o PBS-T (detergente) al 5X, successivamente messe in incubazione con l’anticorpo primario.
Per anticorpo primario si intende un anticorpo in grado di riconoscere, in maniera specifica, la nostra proteina di interesse. Solitamente, questi derivano da siero di animali (ratto, conigli) iniettati con la proteina target. Gli anticorpi primari utilizzati nel western blotting vengono di solito diluiti in determinate concentrazioni ed in BSA o NFM, in base alle informazioni fornite dall’azienda. Il tempo di incubazione con il primario può variare, molto spesso viene effettuato overnight.
6. Lavaggio ed incubazione con anticorpo secondario
La membrana viene sottoposta di nuovo a lavaggio e successivamente incubata con anticorpo secondario. Per secondario si intende un anticorpo in grado di andare a riconoscere e legarsi all’anticorpo primario.
Come anticorpo secondario si usa un siero di animale (di specie diversa da quella in cui è prodotto l’anticorpo primario), immunizzato con anticorpi della specie dell’anticorpo primario. Il secondario è, quindi, un anticorpo diretto contro la parte costante di un anticorpo di specie diversa. Questo anticorpo è marcato con un enzima (es: perossidasi) in grado catalizzare una reazione cromogena quando la membrana viene incubata con il substrato specifico per l’enzima stesso. Il tempo di incubazione con il secondario è di circa un’ora.
7. Lavaggio e rilevazione della proteina
Dopo aver effettuato il lavaggio della membrana per eliminare l’eccesso, questa viene trattata con una soluzione substrato. Se la nostra proteina di interesse era presente sulla nostra membrana, la reazione a catena che sarà avvenuta sarà questa (Fig.1):
- Il primario si sarà legato alla proteina;
- Il secondario si sarà legato alla porzione costante del primario;
- Il substrato reagirà con l’enzima marcatore del secondario;
- Segnale.
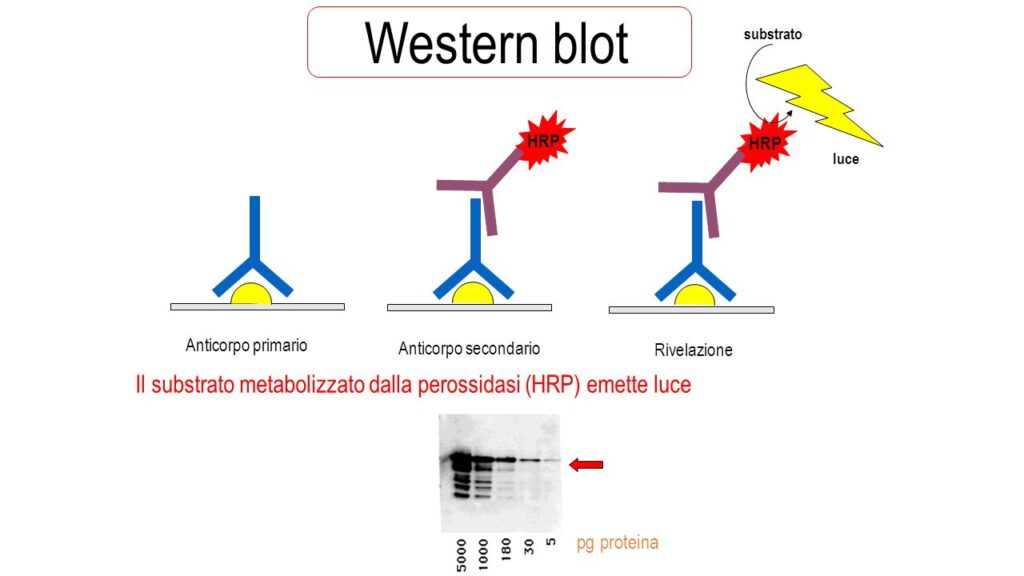
Credits to [https://slideplayer.it/slide/10818632/]
Ed eccolo qui il fotofinish, i nostri campioni sono giunti al traguardo, chi avrà vinto? Rileviamolo.
La rilevazione del segnale può essere svolta in diverse modalità, una delle più tradizionali è quella che utilizza la cassetta di esposizione in camera oscura, come i fotografi.
La membrana viene posta in una cassetta di esposizione, sopra di essa viene adagiata una lastra/film in grado di essere impressionata, la cassetta viene chiusa, si attende un tempo determinato e poi la lastra viene posta prima in un liquido di sviluppo e poi in uno di fissaggio.
Tutto ciò in camera oscura poiché sia la soluzione substrato che le lastre, che i liquidi sono sensibili alla luce. Questa tecnica non è complicata ma necessita di una certa abilità di esecuzione e di tempi più lunghi. Per questo motivo, ad oggi, vi sono tutta una serie di tecniche innovative di imaging che permettono di abbandonare la camera oscura. Questi sistemi (es: chemidoc) sono in grado di rilevare segnali colorimetrici, chemiluminescenti, fluorescenti, nel rosso, nel verde, nel blu ed a UV (Fig.2).

Credits to: [https://www.medicalexpo.it/prod/bio-rad/product-80676-750844.html]
STRIPPING
E’ possibile ricercare più proteine in una stessa membrana e quindi in una stessa corsa. L’unica accortezza che deve esserci è l’uso di giusti anticorpi primari e secondari. Se le due proteine richiedono un anticorpo primario della stessa specie, questi interferiranno fra di loro.
Per questo motivo si effettua prima la rilevazione di una proteina e successivamente si effettua lo “stripping”.
In questa fase, la membrana è posta in una soluzione a base di B-mercaptoetanolo, tris-hcl, SDS e acqua (spesso la soluzione viene fornita dal kit), in questo modo si rompe il legame della precedente proteina con il suo primario e la membrana è pronta ad accettare il secondo primario che andrà a rilevare l’altra proteina target, senza interferenze.
Se i due anticorpi sono di specie differenti invece basterà rilevare la prima proteina e successivamente mettere in incubazione la membrana con il secondo primario.
8. Analisi dei dati
Esistono diversi programmi utili alla quantificazione dei picchi dei nostri segnali (Es: Image-j). Dopo aver ottenuto un numero associato alla quantità del nostro segnale, viene solitamente effettuata la normalizzazione. Per normalizzazione si intende il rapporto della proteina target sul suo totale o su quantificazione di una proteina di riferimento (housekeeping), solo in questo modo sapremo quanto effettivamente la nostra proteina è espressa, fosforilata, metilata, ecc.
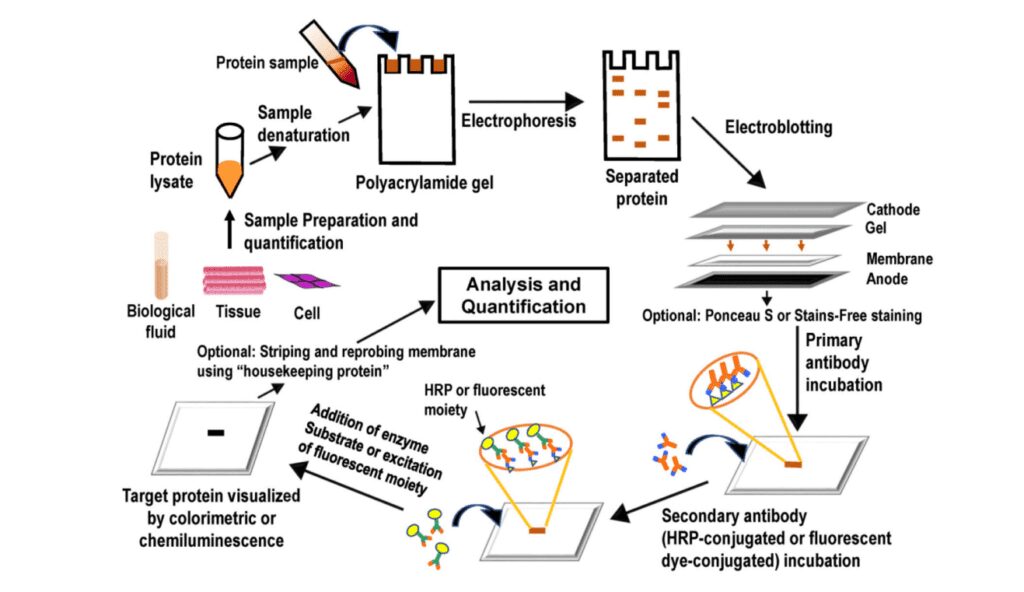
Credits to [Expert Rev Proteomics. 2019. doi:10.1080/14789450.2017.1388167]
Limiti del test
A causa della difficoltà e delle lunghe procedure del western blotting, questo può presentare molteplici limitazioni:
- Maggior probabilità di errore ed una bassa riproducibilità.
- Identificazione di un target poco rappresentato nel campione: trovare una proteina che risulta poco espressa nel nostro campione o valutare modifiche post-trascrizionali (fosforilazione, acetilazione) di proteine che non presentano un’adeguata concentrazione relativa può rivelarsi molto complicato, rischiando di ottenere un dato non statisticamente valido.
- Riconoscimento antigene-anticorpo: può avvenire che l’anticorpo primario o il secondario non siano estremamente efficienti nei confronti del nostro target, o creino un alto tasso di aspecifici, questo può creare problemi ai fini del risultato.
- Stripping delle membrane: è sconsigliato utilizzare più di uno stripping sulle stesse membrane, poiché essendo comunque un trattamento aggressivo può andare anche a determinare una degradazione del nostro target.
- Proteina housekeeping: per normalizzare l’esperimento, si tende a rilevare anche una proteina sempre espressa che faccia da riferimento come ad esempio GAPDH, B-TUBULINA, ecc. Recentemente però (vedi fonti), in diversi laboratori è stato dimostrato come queste proteine non sempre sono effettivamente ubiquitariamente espresse e che quindi si preferisce utilizzare solo forma totale della proteina per la quantificazione del risultato.
- Costi elevati
- Tempi lunghi
Quality control
Al fine di ottenere buoni risultati, è importante avere delle accortezze che consistono in:
- Validazione dell’anticorpo: questa fase non consiste solo nel testare la specificità dell’anticorpo con il proprio target ma anche valutare la sua riproducibilità.
- Controllare che le soluzioni da utilizzare per l’incubazione delle membrane o per il lavaggio (soprattutto le soluzioni proteiche utilizzate per la saturazione) non siano contaminate. La contaminazione può dare problematiche nella rilevazione del target.
- Controllo della corsa e trasferimento: per poter controllare che le proteine siano effettivamente corse sul nostro gel, alla giusta concentrazione, si possono effettuare diverse colorazioni su gel come la Coomassie. Lo stesso vale per verificare il trasferimento su membrana, come ad esempio la colorazione Ponceau Red.
Migliorie apportate negli ultimi anni
Nonostante le molteplici difficoltà ad essa collegate, il western blotting resta comunque una delle tecniche più utilizzate per l’analisi delle proteine. La ricerca anno dopo anno, sta tentando di apportare migliorie per restringere i tempi di durata, probabilità di errore e per renderla maggiormente efficiente.
Alcune di queste sono:
- Kit di GEL: la preparazione del gel, è una procedura molto importante in quanto tende a determinare totalmente l’esito della corsa. Spesso, questa fase può impiegare un’intera giornata di lavoro, per questo motivo esistono aziende che producono gel già pronti per essere utilizzati.
- Elettroforesi capillare e microchip: nel 2016, è stata introdotta una nuova miglioria per la rilevazione delle proteine, un ibrido tra elettroforesi capillare per SDS-PHAGE ed il blotting convenzionale, dotata di una maggiore risoluzione e sensibilità ed in grado di andare a rilevare più proteine contemporaneamente nello stesso campione di lisato cellulare. In sintesi, iniezioni multiple dello stesso campione vengono caricate su un microchip, vengono trasferite su una membrana di PVDF tramite immunoassay e poi rilevate. Nello studio del 2016, sono state rilevate fino a 11 proteine.
- Utilizzo di tecnologie per la rilevazione delle proteine: come detto prima ad oggi esistono già dei sistemi (Es. chemidoc) che ci hanno permesso di eliminare tutto il tempo passato in camera oscura.
Sfruttando le nuove tecnologie, si sta cercando di apportare miglioramenti ad ogni fase del western blotting. Il principio è quello di ridurre le tempistiche, le quantità di campioni e reagenti.
Insomma, non è una tecnica facile, questo l’avrai capito caro lettore, ma ricorda, tu sei il preparatore atletico dei tuoi campioni, credi e tifa per loro e stai sicuro che quando li vedrai rivelarsi al traguardo, sarai la persona più soddisfatta di sempre.
Una banda, è per sempre.
Ilaria Bellini
Fonti
- http://www2.unibas.it
- “Protein purification and analysis: next generation western blotting techniques”. Manish Mishra et al. 2019.
- http://www.unife.it
- “Multiplexed Western Blotting Using Microchip Electrophoresis”. Jin S et al. Chem, 2016.