Caratteristiche
Nell’antica Grecia, il medico Ippocrate (460 – 377 a.C.) documentava le lesioni causate apparentemente dall’herpes simplex virus (HSV) utilizzando il termine herpes. La parola deriva dal greco herpein – rettile ed era utilizzata per descrivere il modo di insinuarsi della malattia, perché le lesioni apparivano vicine l’un l’altra e formavano vescicole. In seguito, Erodoto fu il primo storico a chiamare la malattia herpes febbrile quando essa si manifestava con febbre, piccole vesciche in bocca e piaghe sulle labbra. John Astruc, il medico del re Luigi XIV, invece, pubblicò il libro chiamato De Morbis Veneris in cui scrisse della manifestazione dell’herpes genitale.
Oggi sappiamo che l’HSV è classificato in due tipi: HSV di tipo 1 (HSV-1) e HSV di tipo 2 (HSV-2). Entrambi i virus stabiliscono infezioni che perdurano tutta la vita nell’uomo. La principale via di trasmissione dell’HSV-1 è orale, sebbene la trasmissione sessuale sia sempre più comune nei paesi occidentali ed in Asia. HSV-1 causa piaghe intorno alle labbra o all’interno della bocca che a volte vengono chiamate vesciche da febbre o herpes labiale (Figura 1). Nel caso dell’HSV-2, la trasmissione sessuale è la principale via di trasmissione, provocando solitamente piaghe sui genitali, così come in altre parti del corpo. L’infezione provocata da questi virus è spesso latente ed asintomatica, con frequenti riattivazioni ed occasionali episodi sintomatici intermittenti.
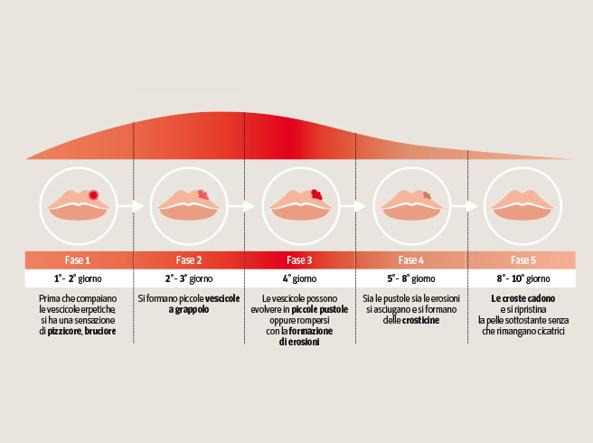
A livello globale l’HSV rappresenta uno dei virus più diffusi. Nel 2015, l’Organizzazione Mondiale della Sanità ha riportato che oltre 3,7 miliardi di persone di età inferiore ai 50 anni (67% della popolazione) sono infetti da HSV-1 e 417 milioni di persone tra 17 e 49 anni sono infetti da HSV-2. Inoltre, l’infezione da HSV-2 incrementa di almeno 4 volte la possibilità di infezione da HIV.
Filogenesi
| Dominio | Acytota |
| Gruppo | Gruppo I (Virus a dsDNA) |
| Famiglia | Herpesviridae |
| Sottofamiglia | Alphaherpesvirinae |
| Genere | Simplexvirus |
Morfologia strutturale
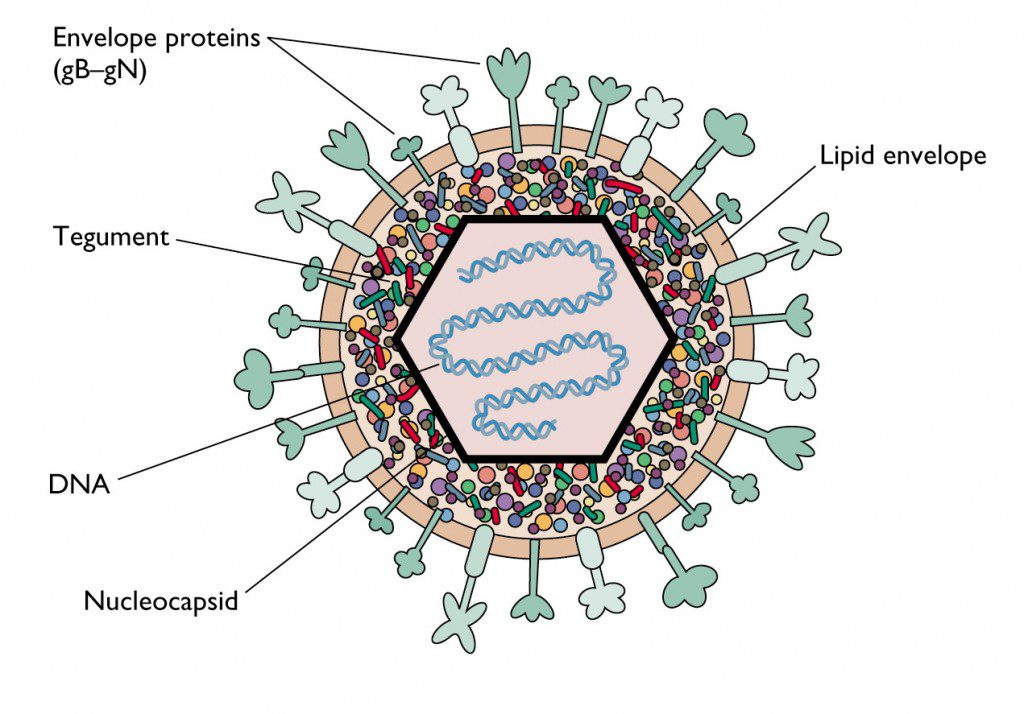
L’HSV è un virus provvisto di pericapside composto da 162 capsomeri e contenente un genoma lineare a doppio filamento di DNA (Figura 2). Il virione sferico di circa 186 nm di diametro è provvisto di glicoproteine ancorate al pericapside. Il genoma è costituito da due componenti legati covalentemente, indicati come L (lungo) e S (corto). Ogni componente è formato da sequenze uniche (UL e US, rispettivamente) affiancate da regioni o sequenze ripetute ed invertite che facilitano la replicazione del genoma. Il peso molecolare del DNA è di circa 150 kbp, con un contenuto di G+C del 68% per HSV-1 e del 69% per HSV-2.
Il capside è composto dalle proteine virali VP5, VP19C, VP23, VP24, VP26 e dalla proteina codificata dal gene UL6. Tra il capside ed il pericapside si trova uno strato proteico amorfo chiamato tegumento. Esso è composto da oltre 20 proteine importanti nella regolazione del ciclo replicativo virale tra le quali vi sono:
- Il fattore α-trans-inducente (α-TIF), noto come VP16, coinvolto nella trascrizione dei geni precoci immediati (IE);
- La proteina di arresto dell’ospite virionico (VHS) o VP22, responsabile della degradazione dell’mRNA della cellula ospite nel citoplasma;
- VP1-2 che può svolgere un ruolo nel rilascio di DNA a livello dei pori nucleari durante l’ingresso virale.
L’involucro è costituito da un doppio strato lipidico ed altre 11 glicoproteine virali, quattro delle quali (gB, gD, gH e gL) sono essenziali per l’ingresso del virus nelle cellule ed innescano la risposta immunitaria nelle cellule ospiti.
Patogenesi
La trasmissione dell’HSV dipende dal contatto intimo e personale tra un individuo sensibile ed un individuo che sta espellendo il virus. Perché l’infezione abbia inizio, il virus deve entrare in contatto diretto con le superfici della mucosa o della pelle con soluzione di continuità. Generalmente, le infezioni da HSV-1 sono limitate all’orofaringe ed il virus viene trasmesso da goccioline respiratorie o da saliva, molto spesso con i baci. L’HSV-2 viene trasmesso principalmente attraverso l’attività sessuale.
In seguito alla replicazione, il nucleocapside viene trasportato attraverso il flusso assonale retrogrado verso i gangli sensoriali o autonomi, dove viene stabilita la latenza, preferibilmente nei gangli trigeminali per HSV-1 e nella radice dorso sacrale per HSV-2.
Le recidive si verificano quando il virus latente viene riattivato. Il processo di riattivazione è innescato da stimoli locali, come lesioni al tessuto neuronale in cui HSV è latente, o da fattori sistemici come stress fisico o emotivo, febbre, esposizione alla luce ultravioletta, mestruazioni e squilibrio ormonale.
La replicazione del virus induce gravi cambiamenti strutturali nelle cellule infette. Tra questi cambiamenti vi sono modifiche della cromatina, frammentazione e dispersione delle membrane dell’apparato del Golgi ed inserimento di proteine virali nella membrana cellulare. Inoltre, si verificano cambiamenti biochimici come blocco della sintesi proteica, degradazione dell’mRNA e degradazione selettiva delle proteine.
La replicazione
La prima fase dell’infezione è costituita dall’adsorbimento, mediato dalle glicoproteine virali che si legano alle catene glicosaminoglicane, presenti sulla superficie cellulare. Tra questi, l’eparan-solfato (HS) è considerato il principale recettore implicato nel legame con l’HSV, con un ruolo chiave nell’aderenza delle glicoproteine C (gC) e B (gB) sulla superficie delle cellule bersaglio. L’interazione di gC e gB con il recettore HS è labile fino alla partecipazione della glicoproteina gD al processo. Diversi recettori cellulari che interagiscono con gD sono conosciuti come mediatori dell’entrata dell’herpes virus (HVEM), nectine 1 e 2, e una specifica forma di HS chiamata 3-O-eparan-solfato. Quando gD interagisce con uno di questi recettori, la sua catena polipeptidica subisce un cambiamento conformazionale che consente l’interazione con l’eterodimero gH/gL. Questa interazione porta alla fusione del capside virale con la membrana plasmatica della cellula bersaglio.
Dopo la penetrazione nel citoplasma, il nucleocapside viene trasportato tramite il citoscheletro nei pori della membrana nucleare, dove il DNA virale viene rilasciato. In questa sede, la proteina VP16 si lega con la proteina Oct-1 formando il complesso di pre-inizio. Inizialmente, il DNA virale viene trascritto dalla cellula ospite raggiungendo un picco dopo 6 ore dall’infezione.
Dopo la replicazione del genoma, vengono prodotte le proteine tardive che formano le proteine strutturali del virus, come le proteine del tegumento, capside e glicoproteine.
A questo punto il nucleocapside è indipendente e può essere espulso dalla cellula bersaglio, con un meccanismo che è ancora poco noto e che sembra dipendere dalle glicoproteine gD e gH. Il processo di replicazione dura da 18 a 20 ore.
Metodi di identificazione
Sebbene sia facile per un medico identificare le infezioni causate da HSV a causa delle tipiche lesioni che causa è comunque necessaria una diagnosi in laboratorio.
Coltura cellulare
Il test più utilizzato per la diagnosi è la coltura cellulare, nel quale le cellule vengono infettate con il virus proveniente dal liquido vescicolare. In questo caso, l’effetto citopatico viene rivelato dopo 2-3 giorni di coltivazione. Le cellule infette si ingrandiscono assumendo un aspetto globulare, una delle caratteristiche riscontrate è la fusione cellulare con una formazione sinciziale.
Reazione a catena della polimerasi (PCR)
La reazione a catena della polimerasi (PCR) viene utilizzata per il rilevamento del genoma virale in campioni con una concentrazione bassa di virus. La PCR, inoltre, è più rapida e sensibile della coltura cellulare per la diagnosi dell’encefalite causata da HSV.
Terapia
I primi antivirali sviluppati per l’infezione da HSV, sono stati analoghi nucleosidici come iodo deossiuridina (IDU) e trifluridina. Il meccanismo d’azione di questi antivirali consiste nell’incorporazione delle loro forme trifosforilate nel blocco del filamento di DNA virale nascente con la conseguente inibizione della replicazione del virus. Questi farmaci non hanno un’attività selettiva, in quanto anche la sintesi del DNA cellulare è compromessa, pertanto sono altamente tossici se somministrati per via sistemica.
Acyclovir
Il principale passo avanti nella terapia dell’infezione da HSV è stato lo sviluppo di analoghi nucleosidici dotati di un meccanismo d’azione selettivo. L’Acyclovir (ACV) è stato il primo e resta ancora la prima scelta per il trattamento della malattia. Altri farmaci, sviluppati in seguito, sono penciclovir, valaciclovir e famciclovir. Essi utilizzano un meccanismo simile ma mostrano una bassa tossicità e migliore biodisponibilità.
Perché l’ACV sia efficace, deve essere fosforilato dalla timidina chinasi (TK); tuttavia, l’affinità della TK virale con il farmaco è cento volte maggiore di quella dell’enzima cellulare. Alcuni meccanismi di resistenza dell’HSV all’ACV si riferiscono ad una completa carenza o bassa attività della TK virale. Circa il 95% dei casi resistenti è attribuito a mutazioni del gene UL23 che codifica per la TK e il 5% di mutazione al gene UL30 che codifica per la DNA polimerasi virale.
Vidarabina
La Vidarabina (Ara-A) è un analogo nucleosidico dell’adenosina ed anch’esso esercita il suo effetto inibendo la sintesi del DNA virale. È stata approvata negli Stati Uniti per la cura di cherato-congiuntivite da HSV, cheratite epiteliale ricorrente ed encefalite. A causa della sua scarsa solubilità, tuttavia, è necessario somministrarne un grande volume per via endovenosa; inoltre viene rapidamente convertita in ipoxantina arabinoside che presenta una debole attività antivirale.
Foscarnet
Il fosfonoformiato o foscarnet è un analogo strutturale del pirofosfato ed è stato utilizzato nelle infezioni resistenti all’ACV. Si lega alla DNA polimerasi virale nel sito del pirofosfato, inibendo in modo non competitivo il legame dei nucleosidi. La resistenza al foscarnet è dovuta a mutazioni puntiformi nella DNA polimerasi ed è tipicamente associata ad un’esposizione prolungata o ripetuta del farmaco. La sua bassa disponibilità e l’insorgenza di intolleranza gastrointestinale ostacolano il suo uso orale e, pertanto, deve essere somministrata per via endovenosa.
Cidofovir
Il Cidofovir è un analogo del fosfonato o citidina. È stato il primo analogo nucleotidico approvato per uso clinico. Per la sua attivazione, la chinasi cellulare si attacca sequenzialmente a due ulteriori gruppi fosfato, convertendo il cidofovir nella sua forma attiva. Poiché l’enzima virale non è necessario per la fosforilazione iniziale del farmaco, si trovano livelli simili di farmaco nelle cellule infette e non infette. La nefrotossicità è un grave problema e, pertanto, il suo uso in terapia richiede cautela.
Vaccini
Il vaccino contro l’HSV non è ancora disponibile, ma la ricerca al riguardo ha contribuito in modo decisivo alla comparsa di nuove tecnologie dell’immunoprofilassi. Il vaccino HSV inattivato con formalina, fu usato già nel 1938, seppure con esiti discreti. In seguito, sono stati testati diversi altri approcci, tra cui mutanti HSV, virus dell’herpes eterologo o non umano, antigeni espressi in vettori viventi e virus geneticamente modificati.
Le strategie di vaccinazione successive includono la replicazione discontinua del virus, noto come “singolo ciclo effettivo disabilitato” o “DISC”. Si tratta di un virus non patogeno ma in grado di indurre risposte immunitarie umorali e cellulari come il normale virus, senza lo sviluppo di alcuna malattia. Gli animali vaccinati con DISC hanno mostrato una protezione statisticamente significativa contro l’infezione primaria da HSV-1 e le epidemie ricorrenti.
I vaccini costituiti utilizzando le subunità glicoproteiche sono ulteriori candidati, poiché gB e gD sono fondamentali nell’attivazione dell’immunità cellulare specifica.
I vaccini contro l’herpes sono difficili da studiare per molte ragioni pratiche, tra cui la natura asintomatica dell’herpes, che rende difficile stabilire l’efficacia del vaccino.
Recentemente, i ricercatori dell’Università della Pennsylvania hanno riportato il loro successo riguardante lo sviluppo di un vaccino contro l’HSV-2. L’obiettivo è che questo vaccino funzioni in modo simile a quello attualmente utilizzato per prevenire le infezioni da HPV e quindi ridurre significativamente le infezioni da herpes. Ciò che rende questo vaccino diverso dagli altri è che si tratta di un vaccino a mRNA. Invece che introdurre l’antigene nella sua forma finale, attraverso l’mRNA si forniscono al corpo le istruzioni su come costruire l’antigene necessario per creare una risposta immunitaria. In caso di successo, il vaccino sarà idealmente usato sugli adolescenti per prevenire l’infezione da herpes prima dell’esposizione.
Federica Angius
Fonti
- Rechenchoski, D. Z., Faccin-Galhardi, L. C., Linhares, R. E. C., & Nozawa, C. (2017). Herpesvirus: an underestimated virus. Folia microbiologica, 62(2), 151-156.
- Chemaitelly, H., Nagelkerke, N., Omori, R., & Abu-Raddad, L. J. (2019). Characterizing herpes simplex virus type 1 and type 2 seroprevalence declines and epidemiological association in the United States. PloS one, 14(6).
- Awasthi, S., Hook, L. M., Pardi, N., Wang, F., Myles, A., Cancro, M. P., … & Friedman, H. M. (2019). Nucleoside-modified mRNA encoding HSV-2 glycoproteins C, D, and E prevents clinical and subclinical genital herpes. Science immunology, 4(39), eaaw7083.
- www.corriere.it