Brevi cenni sui virus che causano epatite
I virus che causano epatite, quindi dei danni al fegato, sono sei. Ciascuno di essi è denominato con una lettera dell’alfabeto, dalla A alla E, più la G, e differiscono tra loro per caratteristiche quali la modalità di replicazione e trasmissione, la loro struttura, nonché il decorso clinico e le conseguenze derivanti dalla malattia.
Questi patogeni, appartenenti a differenti famiglie di virus, sono responsabili di un’infezione che esita in una sintomatologia comune: ittero e aumento degli enzimi epatici. Le differenze tra di essi si possono riassumere e semplificare come segue:
- epatite A e epatite B, le più note, sono causate rispettivamente da HAV (Hepatitis A Virus) e HBV (Hepatitis B Virus)
- i virus dell’epatite C, G, E e D (o agente delta) sono detti virus dell’epatite non-A e non-B (NANBH)
- epatite A (definita infettiva) ed epatite E (enterica) sono simili ed autolimitanti, contrariamente ai tipi C, B (epatite da siero) e D che possono portare a cronicizzazione, oltre che a cancro del fegato ed a cirrosi
- HBV è l’unico virus a DNA che causa epatite, tutti gli altri sono virus a RNA
La scoperta di HEV
| 1978 | 1983 | 1990 e oltre |
| Sospetto | Identificazione | Clonazione parziale prima e sequenziamento dell’intero genoma poi |
L’epidemia di ittero che si verificò nel 1978, nella valle del Kashmir, nell’India settentrionale, diede inizio alle indagini che portarono alla scoperta di HEV. Le prime osservazioni vennero condotte dal dottor Dr. Mohammad S Khuroo, il quale studiò quanto avvenne durante l’outbreak che coinvolse duecento villaggi con una popolazione di 600000 abitanti. Circa 52000 individui svilupparono malattia itterica e 1700 morirono. Molte delle vittime dei casi sintomatici si riscontarono in donne gravide, la cui incidenza e severità della patologia si rivelarono essere maggiori rispetto al resto della popolazione.
Successive epidemie hanno portato a condurre un’indagine casa per casa che ha consentito di stabilire che:
- la malattia aveva colpito giovani adulti di età compresa tra i 15 ed i 45 anni
- la trasmissione avveniva per via enterica
- vi era una relazione tra la malattia e la gravidanza. Emerse infatti che il patogeno era trasmesso verticalmente con elevata mortalità fetale e perinatale
- la malattia era autolimitante e non aveva causato viremia cronica, epatite cronica e cirrosi
- in un periodo di oltre 14 anni, si è verificata la perdita di IgG in più della metà della popolazione
La raccolta di tali osservazioni condusse ad una conclusione: la malattia era causata da un virus dell’epatite umano che ancora non era stato riconosciuto. Era inoltre stata identificata una malattia sporadica simile, sia per epidemiologia sia per caratteristiche cliniche, alla patologia epidemica causa di metà delle epatiti acute.
L’identificazione di HEV
Il 1983 fu l’anno in cui avvenne la svolta ed il virus venne identificato. Durante l’occupazione Sovietica dell’Afghanistan, si verificò un nuovo focolaio di NANBH all’interno di una base militare dell’esercito russo. L’epidemia ad eziologia sconosciuta aveva caratteristiche epidemiologiche analoghe a quelle che si erano verificate in India cinque anni prima.
Il dottor Mikhail Balayan, un medico militare in servizio presso la base russa, si dedicò allo studio dell’epidemia, nonostante i mezzi limitati di cui disponeva sul campo, ricercando la causa che aveva infettato e fatto ammalare gli uomini del distaccamento. Non ci volle molto prima di rendersi conto che, per individuare il patogeno, avrebbe dovuto fare rientro in patria ed avvalersi di metodiche appropriate, ma non era possibile trasportare a Mosca i campioni biologici ottenuti dai diversi soldati affetti. Tutte queste limitazioni però non scoraggiarono il dottor Balayan che pensò ad una soluzione alternativa e coraggiosa per raggiungere il suo scopo.
L’esperimento del dottor Balayan
Divenne egli stesso il vettore per il virus, trasformandosi volontariamente in una cavia umana. Il dottor Balayan decise di utilizzare i campioni di feci che aveva raccolto dai soldati infetti per contagiarsi. Mescolò a dello yogurt il materiale biologico in suo possesso e lo ingerì. 36 giorni dopo l’ingestione dei campioni fecali, il dottor Balayan manifestò gli stessi sintomi che aveva potuto osservare negli altri pazienti.
Fatto rientro in patria, il dottor Balayan analizzò i campioni delle sue feci, in cui venne detettato un nuovo virus mediante l’ausilio della microscopia elettronica. I campioni di feci del 28° giorno, 43° giorno e 45° giorno palesarono la presenza di particelle virali di 32 nm VLP (Virus-Like Particle) che avevano causato malattia simile all’epatite quando inoculate nelle scimmie durante la sperimentazione.
Grazie a questa indagine, il dottor Balayan riuscì a dimostrare che HEV era un virus diverso da HAV a cui tanto sembrava somigliare. Egli notò che gli anticorpi che aveva sviluppato contro il virus dell’epatite A in una precedente infezione non reagirono contro il nuovo agente patogeno che aveva avuto modo di studiare.
Il rapporto del dottor Balayan
Nella stesura del rapporto in cui riportò quanto osservato, il dottor Balayan ha menzionato sé stesso come segue:
“Hepatitis E virus (HEV) was first identified in the excreta of an experimentally infected human volunteer and further confirmed by similar findings in clinical specimens from patients with acute jaundice disease different from hepatitis A and B.”
ovvero:
“Il virus dell’epatite E (HEV) è stato identificato per la prima volta negli escrementi di un volontario umano infettato sperimentalmente e ulteriormente confermato da risultati simili in campioni clinici di pazienti con ittero acuto diverso da epatite A e B”.
Nel 1990 vennero poi caratterizzate sequenze parziali del virus a cui seguì il sequenziamento dell’intero genoma dei ceppi isolati in Asia e Messico dove il patogeno stava diffondendo in modo epidemico.
Venne inoltre condotta un’analisi retrospettiva di svariati rapporti in cui si riferiva la descrizione di epidemie di itterizia caratterizzate da una maggiore percentuale di infezione nelle donne gravide, in modo da individuare epidemie simili all’epatite nell’ultimo decennio del diciottesimo secolo.
Focus su HEV
Tassonomia
Il virus dell’epatite E (HEV o anche E-NANBH), in seguito a diversi studi che ne hanno determinato morfologia e genoma, è stato classificato come unico membro del genere degli Hepevirus della famiglia Hepeviridae, della quale fanno parte i generi Orthohepevirus e Piscihepevirus.
Il genere Orthohepevirus A comprende otto genotipi (da HEV-1 a HEV-8), dei quali:
- HEV-1 e HEV-2 sono stati rilevati soltanto nell’uomo
- HEV-3 e HEV-4 sono stati evidenziati sia nell’uomo sia in diverse specie animali, di cui il maiale rappresenta il maggior reservoir
- HEV-5 e HEV-6 sono invece stati trovati solo nei cinghiali
- HEV-7 nell’uomo e nei camelidi.
- HEV-8 proviene dai cammelli bactriani e potrebbe infettare l’uomo in modo simile al genotipo 7
Nei polli domestici è stato invece rinvenuto il genere Orthohepevirus B, costituito da virus aviari e suddiviso in quattro sottotipi (I-IV).
Il genere Piscihepevirus infetta solo le trote, ma è la far notare che la gamma di ospiti che può colpire e la sua patogenicità restano sconosciute.
L’analisi molecolare che ha permesso di rilevare questi genotipi, in particolare quelli da G 1 a G4, comprendenti ciascuno vari sottotipi, caratterizzati da comportamento diverso tra loro, e di individuare aree di localizzazione in differenti regioni geografiche, denota una vasta diffusione del virus in tutto il mondo.
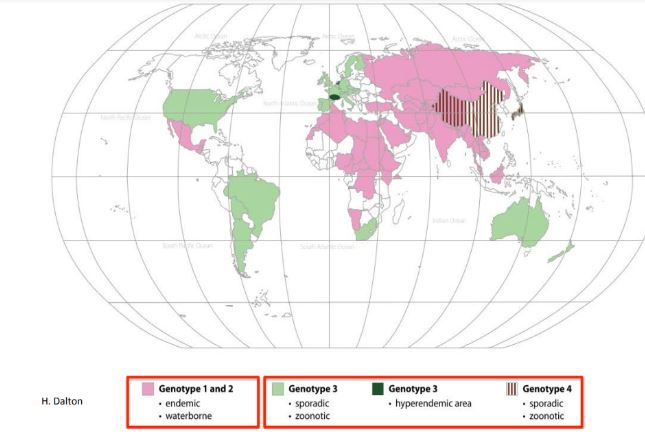
La diffusione del virus HEV
L’infezione nell’uomo si manifesta sia in forma endemica sia, occasionalmente, in forma epidemica nei Paesi in via di sviluppo, ma infezione e malattia sono presenti anche in paesi industrializzati. Frequenti sono i focolai segnalati successivamente a eventi meteorologici estremi (grandi piogge ed alluvioni), che aumentano il rischio di contaminazione fecale delle fonti idriche.
Grazie all’esecuzione di analisi filogenetiche è stata evidenziata una caratteristica interessante del virus: la territorialità. Il ceppo animale di HEV isolato in una determinata regione è strettamente correlato con il ceppo umano nella medesima area e viceversa, divergendo profondamente con ceppi isolati invece in altre regioni.
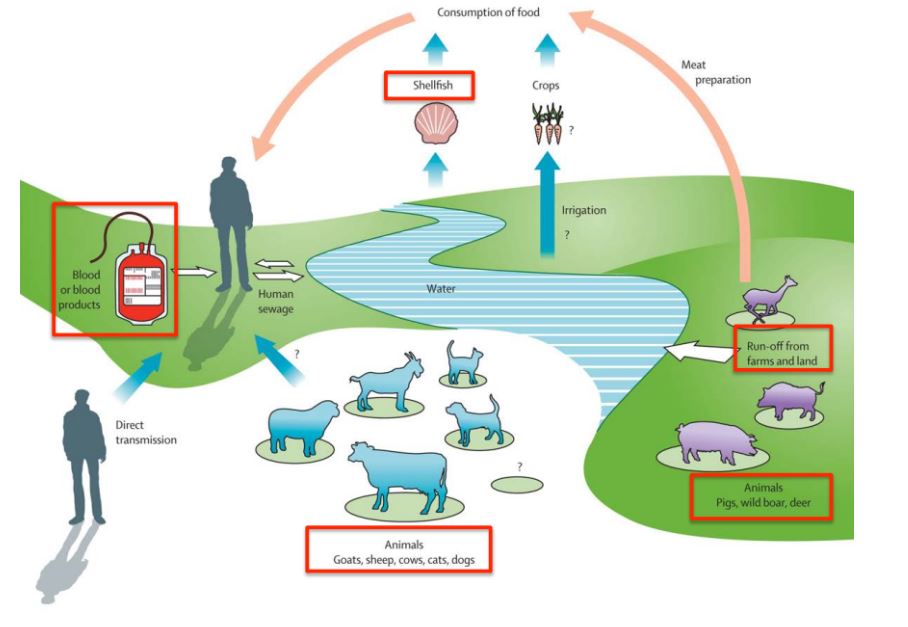
La trasmissione del virus
Le principali vie di trasmissione di HEV sono:
- oro-fecale: per via idrica, quindi anche acqua di irrigazione, soprattutto nei paesi in via di sviluppo nei quali il trattamento delle acque reflue è inadeguato, ma essendo HEV resistente all’ambiente questo tipo di trasmissione si verifica anche nei paesi sviluppati con ingestione di acqua non trattata
- zoonotica: consumo di carne cruda o poco cotta di cervo, cinghiale, maiale e frutti di mare
- verticale (da madre a figlio)
- associata a trasfusioni
Relativamente al rischio zoonotico, HEV è dotato di una spiccata capacità di trasmettersi da una specie all’altra, caratteristica che è stata documentata dalla trasmissione del virus suino ai primati non umani ed all’uomo e di HEV umano ai suini.
Genoma di HEV
Il virus, piccolo, privo di envelope, con capside icosaedrico, ha un genoma costituito da RNA a singolo filamento a polarità positiva (+ssRNA). Ha la capacità di agire direttamente come mRNA, composto da 7200 basi circa con un cappuccio di 7-metilguanina all’estremità 5′ e una coda poli (A) all’estremità 3′.
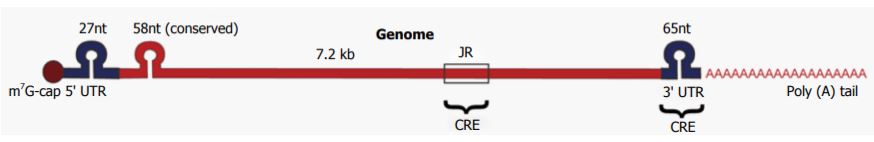
Possiede due regioni UTR (Untranslated Region), una al 5’ di 27 nt ed una all’estremità 3’ di 65 nt. Il tratto conservato di 58 nt si trova subito dopo la UTR al 5’, all’interno della ORF1 (Open Reading Frame) che si piega a formare strutture ad anello e a forcina.
L’RNA dell’HEV si replica in un RNA genomico di 7,2 kb e in un RNA subgenomico bicistronico di 2,2 kb.
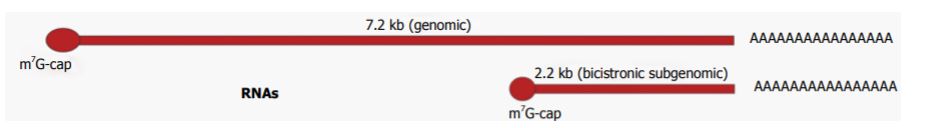
ORF
HEV esprime tre ORF:
- ORF1 – è il più grande e codifica per proteine non strutturali con otto domini putativi:
- una metiltransferasi (Met)
- un dominio Y (Y)
- una cisteina proteasi simile alla papaina (PCP)
- una regione ipervariabile (HVR)
- un dominio ricco di proline (PRO)
- un macrodominio X (X)
- una RNA elicasi (Hel)
- una RNA polimerasi RNA-dipendente (RdRp).
Gli enzimi prodotti da ORF1 sono coinvolti nel processo di replicazione virale, nella trascrizione e nella scissione di poliproteine.
- ORF2 – codifica per pORF2, una proteina strutturale del capside, che possiede tre siti di glicosilazione e un peptide segnale amino-terminale che determina la traslocazione nel reticolo endoplasmatico. Tale proteina è inoltre coinvolta in deversi processi, quali l’assemblaggio del virus, l’incapsulamento, il legame e la risposta immunitaria dell’ospite al virus.
- ORF3 – il più piccolo dei tre, si trova tra ORF1 e ORF2 sull’ultimo dei quali si sovrappone parzialmente. Codifica per una piccola fosfoproteina (pORF3) con molteplici funzioni:
- è in grado di legarsi ai microtubuli del citoscheletro dei mammiferi
- sembra agire come adattatore per collegare le vie di trasduzione intracellulari
- riduce la risposta infiammatoria dell’ospite
- protegge le cellule infettate dal virus
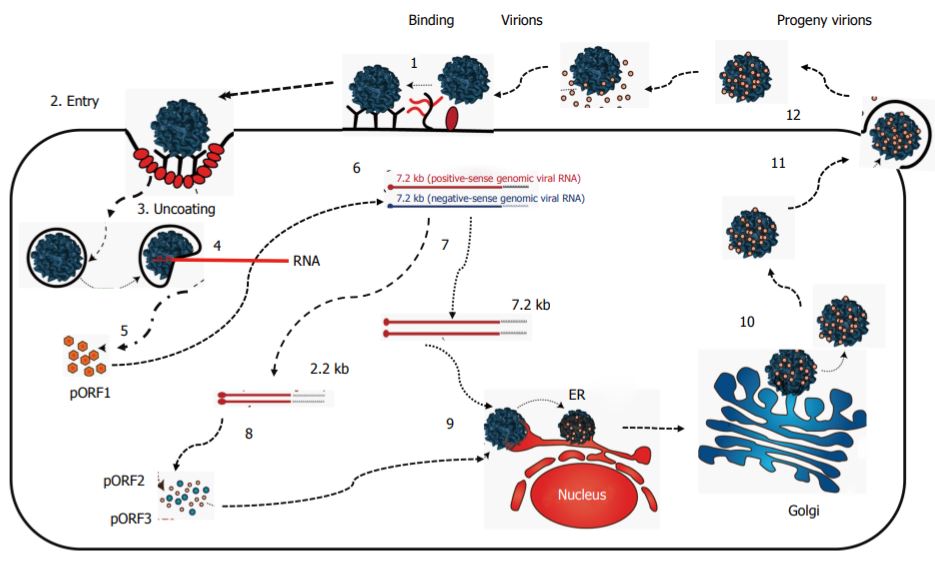
Il ciclo di vita
Il ciclo di vita del virus non è stato studiato a fondo per la mancanza sia di un modello di coltura in vitro adeguato sia un modello animale. Recentemente sono stati sviluppati metodi di coltura in vitro per HEV e si è ipotizzato un possibile meccanismo di replicazione basandosi su studi di analisi del genoma ed analogie con altri virus a RNA noti.
Si assume che tale ciclo cominci con l’entrata per endocitosi del patogeno negli epatociti attraverso il legame a specifici recettori. Un intermedio di replicazione, ovvero l’RNA virale con polarità negativa, è stato rilevato anche a livello dell’intestino e nei linfonodi dei suini, mentre negli esseri umani infetti lo si è trovato nel cuore e nel liquido cerebrospinale.
Il virus quindi rilascia il suo RNA nel citoplasma cellulare e comincia la traduzione delle proteine non strutturali. In seguito alla traduzione, l’RNA genomico viene copiato in un filamento di RNA negativo grazie a una RNA polimerasi RNA dipendente, che consente la sintesi di RNA genomici e subgenomici.
pORF2 e pORF3 sono tradotte e producono la proteina del capside e la fosfoproteina che consentiranno di incapsulare i filamenti appena sintetizzati di RNA virale e ottenere nuove particelle virali.
L’interazione delle proteine codificate da ORF2 e da ORF3 suggerisce che ORF3 giochi un ruolo sia nell’assemblare il virus sia durante il rilascio dei virioni per via esosomiale.
Si è rilevato che ORF3 e lipidi sono associati ai virus secreti nel flusso sanguigno. Il rivestimento di pORF3 e dello strato lipidico verrà poi perso per separazione degli stessi una volta fuori dalla cellula epatica.
Clinica
Il decorso e la presentazione clinica dell’infezione da HEV sono molto variabili.
La malattia ha esordio improvviso, dopo un periodo di incubazione di 15-50 giorni. Il grado di severità con cui può manifestarsi è molto ampio e tende ad aumentare con l’età del paziente. Nella maggior parte dei casi, l’epatite E è asintomatica, altre volte invece si palesa in forma sintomatica che può essere lieve o grave e portare ad insufficienza epatica.
Sintomi e decorso della malattia sono simili a quelli provocati da HAV, sebbene questi possano comparire tardivamente rispetto a quelli dell’epatite A, e risulta particolarmente grave nelle donne gravide la cui mortalità, solitamente attestata intorno all’1% – 2% in pazienti normali, sale al 20% soprattutto durante il primo trimestre.
La fase prodromica è variabile. Si possono manifestare disturbi digestivi, astenia e febbre per diversi giorni, che sono poi seguiti da una fase itterica di due settimane e aumento dei valori degli enzimi epatici.
Contrariamente ad altre epatiti virali, la malattia acuta non ha tendenza a cronicizzare eccetto che nei pazienti immunocompromessi nei quali può esitare anche in cirrosi. La cronicità è definita da una viremia persistente per tre-sei mesi dopo l’avvenuta diagnosi.
L’epatite E ha una risoluzione spontanea ed avviene nell’arco di 3-4 settimane, ma occasionalmente l’epatite acuta evolve in individui con patologie epatiche sottostanti in epatite fulminante.
Talvolta si associano complicazioni di origine neurologica, nefrologica, ematologica oltre ad altre manifestazioni extraepatiche come miositi, pancreatiti acute, miocarditi, miastenia, tiroidite ed artralgie.
Diagnosi
Essendo la maggior parte dei casi di epatite E asintomatica e dato che le forme cliniche non sono specifiche, la diagnosi mediante lo studio dei segni clinici risulta complicata ed è necessario avvalersi della rilevazione di alcuni marcatori che possono dare indicazione anche di una precedente infezione da parte di HEV. Tali marcatori sono: anticorpi anti-HEV IgG e IgM, genoma virale nel sangue e nei fluidi corporei, e l’attività dell’alanina aminotransferasi.
IgM anti-HEV
Le IgM anti-HEV sono le prime a comparire dopo l’infezione e mostrano un picco, in media, all’ottava settimana. Possono essere rilevate fino a 32 settimane dopo il contagio. Subito dopo compaiono le IgG anti-HEV. Questi due anticorpi stabiliscono la tempistica dell’infezione. La rilevazione delle IgM denota infatti un’infezione recente, così come la presenza del genoma virale nel sangue e nelle feci, mentre le IgG possono essere rilevate per anni dopo l’infezione, quindi marcatori di un’infezione più vecchia.
Il saggio ELISA
La combinazione del saggio ELISA e della rilevazione dell’acido nucleico di HEV, la si predilige nei casi di infezione acuta. L’individuazione dei genotipi di HEV implicati nella genesi della malattia umana si rivela clinicamente importante e la quantificazione virale assume un ruolo centrale nel monitoraggio della risposta alla terapia.
ALAT
L’attività del marker ALAT (alanina-aminotransferasi) compare 2-3 settimane dopo l’infezione, mostrando un picco alla sesta settimana, in concomitanza con l’inizio della fase itterica, ma è da considerare che questo enzima non è specifico per l’epatite E, ma denota sintomatologia a carico del fegato e del quale si riscontrano valori moderatamente elevati nei pazienti immunocompromessi.
Si indagano anche elevati livelli di bilirubina e quelli di altri enzimi epatici, compresi di ALT e GGT, per individuare uno stato infiammatorio o una lesione del parenchima epatico.
La diagnosi dovrà inoltre escludere il danno epatico indotto da farmaci (DILI – Drug induced liver disease) con il quale l’epatite E è spesso confusa e per tale ragione non diagnosticata.
Controllo e terapia
La prevenzione ed il controllo della malattia nei paesi in via di sviluppo rappresenta una sfida per la mancanza di mezzi con cui assicurare una fornitura di acqua potabile pulita, servizi igienico-sanitari adeguati oltre che il corretto smaltimento delle acque reflue e buone pratiche di igiene personale.
Viaggiatori che si recano in paesi ad alta incidenza di infezioni da HEV dovrebbero cautelarsi astenendosi dal consumo di bevande contaminate e di crostacei crudi. I pazienti SOT (trapiantati di organo solido), quindi immunocompromessi, dovrebbero anch’essi consumare carni ben cotte, in modo da inattivare il virus.
In individui immunocompetenti, il trattamento dell’epatite E è sintomatico.
L’utilizzo di farmaci che inducono errori di replicazione e trascrizione del genoma virale originando mutazioni che inattivano gli mRNA e le proteine (es. Ribavirina) producono un rapido abbassamento dei valori degli enzimi epatici già nell’arco di tre settimane di trattamento. I benefici dell’utilizzo di un farmaco teratogeno come la Ribavirina, superano i rischi di una malattia non trattata in una donna gravida.
Vaccino
Gli studi immunologici condotti sulla regione del capside hanno contribuito a sviluppare un vaccino contro HEV che, nel 2012, è stato commercializzato in Cina. Questo vaccino, basato sul genotipo 1, è dotato di efficacia cross-genotipica.
La sua efficacia si attesta tra il 94% e il 100% nel prevenire casi sintomatici acuti.
Fonti
- Patrick R Murray, Ken S. Rosenthal, Michael A. Pfaller – Microbiologia Medica sesta edizione – Elsevier
- Eudes Panciotti – Microbiologia Clinica 2 ^ Edizione – Casa Editrice Ambrosiana
- The Struggle Against Yellow fever: Featuring Walter Reed and Max Theiler, Posted on the blog May 13, 2014.
- Balayan, M.S., 1983. Hepatitis E virus infection in Europe: Regional situation regarding laboratory diagnosis and epidemiology. Clinical and Diagnostic Virology 1:1-9.
- Khuroo MS. Hepatitis E: the enterically transmitted non-A, non-B hepatitis. Indian J Gastroenterol 1991; 10: 96-100 [PMID: 1916971]
- BANKS M., BENDALL R., GRIERSON S., HEATH G., MITCHELL J., DALTON H. (2004) – Human and porcine Hepatitis E virus strain, United Kingdom. Emerg. Infect. Dis., 10(5), 953-955
- HE J., INNIS B.L., SHRESTHA M.P., CLAYSON E.T., SCOTT R.M., LINTHICUM K.J., MUSSER G.G., GIGLIOTTI S.C., BINN L.N., KUSCHNER R.A., VAUGHN D.W. (2002) – Evidence that rodents are a reservoir of hepatitis E virus for humans in Nepal. J. Clin. Microbiol., 40(12), 4493-4498
- Khuroo MS, Kamili S, Jameel S. Vertical transmission of hepatitis E virus. Lancet 1995; 345: 1025-1026 [PMID: 7723501]
Altre fonti
- MENG X.J., WISEMAN B., ELVINGER F., GUENETTE D.K., TOTH T.E., ENGLE R.E., EMERSON S.U., PURCELL R.H. (2002) – Prevalence of antibodies to hepatitis E virus in veterinarians working with swine and in normal blood donors in the United States and other Countries. J. Clin. Microbiol., 40(1), 117-122
- Khuroo MS, Duermeyer W, Zargar SA, Ahanger MA, Shah MA. Acute sporadic non-A, non-B hepatitis in India. Am J Epidemiol 1983; 118: 360-364 [PMID: 6412542]
- Balayan MS, Andjaparidze AG, Savinskaya SS, Ketiladze ES, Braginsky DM, Savinov AP, Poleschuk VF. Evidence for a virus in non-A, non-B hepatitis transmitted via the fecal-oral route. Intervirology 1983; 20: 23-31 [PMID: 6409836]
- Bradley DW, Purdy MA, Reyes GR. Hepatitis E virus genome. Molecular features, expression of immunoreactive proteins and sequence divergence. J Hepatol 1991; 13 Suppl 4: S152-S154 [PMID: 1822509]
- Abravanel F et al. Characteristics of Autochthonous Hepatitis E Virus Infection in Solid-Organ Transplant Recipients in France. 2010. The Journal of Infectious Diseases; 202: 835–844
- Abravanel F et al. Genotype 3 Diversity and Quantification of Hepatitis E Virus RNA. 2012. Journal of Clinical Microbiology; 50: 897-902.
- Mohammad S Khuroo, Mehnaaz S Khuroo, Naira S Khuroo Hepatitis E: Discovery, global impact, control and cure. World J Gastroenterol 2016 August 21; 22(31): 7030-7045
- Lisandru Capai, Rémi Charrel and Alessandra Falchi, Review: Hepatitis E in High-Income Countries: What Do We Know? And What Are the Knowledge Gaps?, 25 May 2018
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4988308/