Neurovirulenza e coronavirus: quale correlazione?
In questo articolo, a cavallo tra microbiologia medica e psicologia clinica, passiamo in rassegna gli aspetti più salienti relativi al Sars-CoV-2 e alle ipotesi di neurovirulenza nella sindrome long Covid determinata da infezione del coronavirus nel contesto logico della psiconeuroimmunologia.
L’epidemia di Covid-19 si distingue per la velocità con la quale è passata a fenomeno pandemico. La rapida propagazione del virus ha mostrato alcuni aspetti psicologici di primario interesse per la salute pubblica, associati alla percezione del pericolo, all’esposizione al contagio per le classi sociali meno agiate, alle variabili di personalità individuale e alle dinamiche sociali. Col passare dei mesi, tuttavia, oltre agli aspetti prettamente psichici relativi alla pandemia, l’affacciarsi di sintomi prolungati in certi pazienti, dopo la guarigione dall’infezione propriamente detta, ha spostato il focus sul terreno psico-neuroimmunologico.
La neurovirulenza del Coronavirus
L’ipotetica neurovirulenza del coronavirus richiede di scorporare 2 ipotesi, non necessariamente escludenti:
- un probabile neurotropismo del virus con effetto citotossico diretto sui tessuti nervosi.
- una risposta sistemica per la cosiddetta “cytokin storm” e quindi un effetto indiretto del germe sull’ospite.
Il contesto generale: i Coronaviridae (CoV)
I Coronavirus rappresentano la seconda causa del raffreddore comune negli umani dopo i Rhinovirus. Questo, però, non significa che la patogenicità di tutti i virus di questo gruppo sia clinicamente così poco rilevante. Non a caso, alcuni virus della famiglia dei Coronavirus (CoV), che infettano altre specie animali, presentano diversi gradi di neurovirulenza. Nel maiale, ad esempio, una grave malattia cerebrale, l’encefalomielite emoagglutinante, ha come agente eziologico un virus che ha il 91% di omologia (ovvero somiglianza genetica) con un coronavirus umano, l’OC43.
Anche gatti e topi possono essere infettati da Coronavirus neuroinvasivi, e sebbene non siano delle zoonosi e pertanto non costituiscano – ad oggi – alcun pericolo per l’uomo, il fatto che alcuni CoV possano mostrare una certa neurovirulenza basta per far scattare l’attenzione verso il Sars-CoV-2 umano. Di fatto, vi furono episodi di encefalomielite da MERS, ma le infezioni primarie del SNC da Coronavirus sembrano essere infrequenti. Ciò che preoccupa è altro, ovvero i casi di pazienti post-Covid – clinicamente guariti dall’infezione – che accusano sintomi aspecifici prolungati per settimane dopo il primo episodio infettivo, aspetto che sta avendo un certo impatto per il numero di soggetti coinvolti.
Inizialmente tale sintomatologia veniva associata agli esiti psicotraumatici secondari al senso di solitudine in ospedale, all’impossibilità di vedere i propri cari e all’incertezza del vissuto; oggi vengono visti secondo una prospettiva multidisciplinare. Il Sars-CoV-2 è un virus a RNA appartenente, come sappiamo, ai Coronaviridae (CoV). Di questa famiglia di virus, caratterizzati da una spiccata capacità ricombinate, il Sars-CoV-2 si aggiunge ad altri sei in grado di infettare l’organismo umano:
- Alfacoronavirus 229E (HCov-229E)
- Alfacoronavirus NL63 (HCoVNL63)
- Betacoronavirus HKU1 (HCoV-HKU1)
- Betacoronavirus OC43 (HCoV-OC43)
- MERS-Cov
- Sars-Cov
I primi quattro sono endemici a livello mondiale e costituiscono, appunto, l’agente eziologico nel 10% dei casi di raffreddore comune, ma i CoV umani sono entrati con prepotenza sulla scena mondiale agli inizi del XXI secolo.
Severe Acute Respiratory Syndrome: SARS
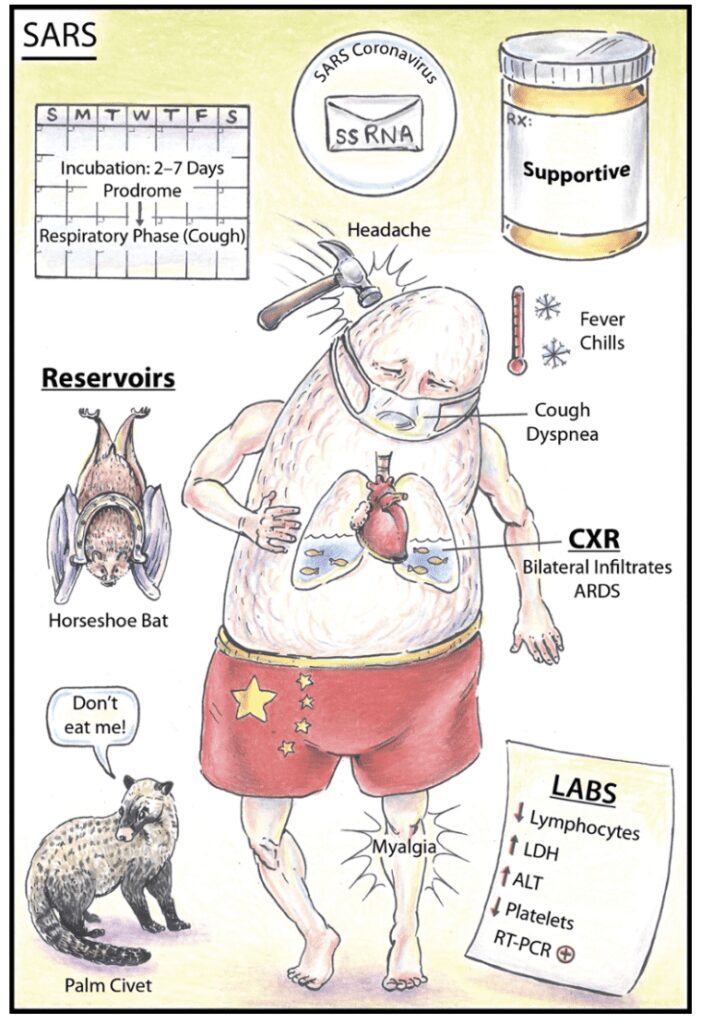
Il 15 marzo del 2003 l’OMS allertava per la presenza di focolai infettivi di una polmonite atipica nella provincia cinese di Guangdong, il cui patogeno fu poi identificato come un CoV. La malattia presentava una patogenesi prevalentemente a carico delle vie respiratorie, da cui il nome SARS (Severe Acute Respiratory Syndrome). Il virus si diffuse in 32 Stati, ma il focolaio infettivo più importante, al di fuori dei confini cinesi, si ebbe in Canada nella città di Toronto. Non fu chiaro sin da subito quale potesse essere il serbatoio dell’infezione. Inizialmente si pensò allo zibetto quale reservoir naturale, ma ben presto si capì che questo piccolo animale, sviluppando lui stesso la malattia, ne costituiva un semplice ospite intermedio. Posteriormente si identificò in una specie di pipistrello (il Rhinolophus) l’ospite naturale del patogeno. Il tasso di letalità fu del 10,9%.
Middle East Respiratory Syndrome: MERS
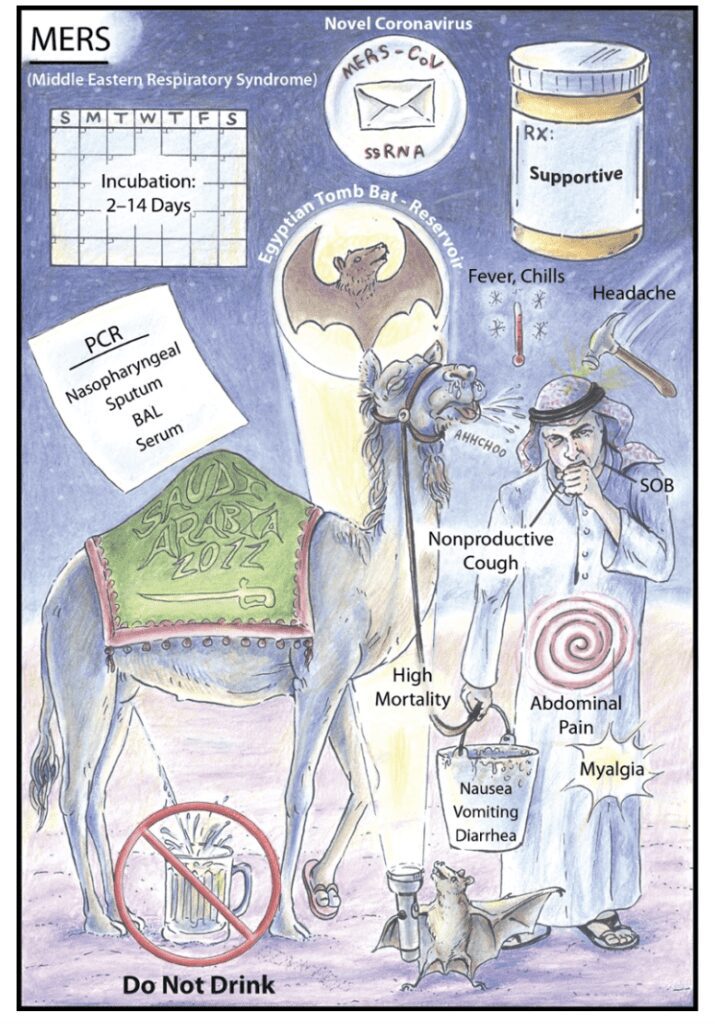
Dieci anni dopo scoppiava una nuova epidemia, questa volta con un tasso di letalità ben più alto della precedente, del 34,4%. La malattia si estese nel 2012 ed ebbe come principale area la Giordania e l’Arabia Saudita, ovvero il Medioriente, da cui il nome MERS (Middle East Respiratory Syndrome), anche se nel 2015 si verificò un importante focolaio in Corea del Sud. Nell’ecologia del virus anche in questo caso si identificarono i pipistrelli (Pipistrellus e Perimyotis) come reservoir naturali, e i cammelli e i dromedari come ospiti intermedi.
Gli aspetti del genoma
Le alte capacità ricombinanti di questi virus e gli studi filogenetici avvallano l’ipotesi che il Sars-CoV-2 abbia fatto anch’esso un salto di specie. La sequenza genomica del Sars-CoV-2 fu resa pubblica dalle autorità cinesi nel database GenBank (MN908947) e presenta una omologia del 96,2% con il Coronavirus BatCoV RaTG13 (Fig. 2), isolato in un pipistrello nella provincia dello Yunnan, e dell’82% col SARS-CoV. È ormai parere condiviso, nella comunità scientifica internazionale, identificare negli allevamenti misti suini e avicoli, e nei più conosciuti “wet markets” i luoghi privilegiati dove ceppi virali diversi di specie animali dissimili possono ricombinarsi geneticamente e favorire gli infausti spillover.

Il genoma virale codifica per quattro proteine strutturali: la proteina E dell’envelope, la M della membrana, la N del nucleocapside e le assai note già citate S (spikes), che si trovano sulla superficie virale e conferiscono il caratteristico aspetto a corona del virus osservato al microscopio elettronico. La Spike-protein ha due sub-unità, la sub-unità S1 è responsabile del tropismo virale, mentre la sub-unità S2 è coinvolta nella fusione con le cellule dell’ospite ed è in grado di legarsi al recettore angiotensin-converting enzime 2, conosciuto come ACE2, che si trova negli pneumociti, nelle cellule dell’endotelio vascolare, del muscolo liscio e nei reni. Si deduce, quindi, che il quadro clinico interessa prevalentemente questi distretti, in special modo le vie respiratorie con un effetto citopatico sulle cellule polmonari e manifestazioni respiratorie anche gravi.
Long-Covid
Questa sorta di sindrome post-Covid che vede una lenta scia di sintomi dopo la guarigione dall’infezione propriamente detta, è stata definita “Long Covid”. Si evince, dalla poca letteratura ad oggi pubblicata, un quadro clinico vago, con una sintomatologia molto varia tra cui la cosiddetta “nebbia cognitiva” o “nebbia mentale”, con la quale ci si riferisce ad un insieme di sintomi che si possono riscontrare anche in altre infezioni virali:
- Senso di disorientamento
- Confusione mentale
- Difficoltà a concentrarsi
- Disturbi della memoria a breve termine
A parte le persone paucisintomatiche o totalmente asintomatiche, i pazienti sintomatici presentano una neutrofilia (ovvero un aumento dei neutrofili) e una linfopenia (una diminuzione delle cellule T e cellule B e quindi delle NK). Proprio questa neutrofilia, che si verifica anche nella SARS, potrebbe concorrere ad aumentare la risposta infiammatoria, già avviata dalla tempesta di citochine IL-6, IL-10 e soprattutto IL-1. I neutrofili sono infatti responsabili di produrre il cosiddetto NET (neutrophil extracellular trap) una risposta adattativa al patogeno che, se non modulata dai linfociti, potrebbe rafforzare la risposta infiammatoria stessa.
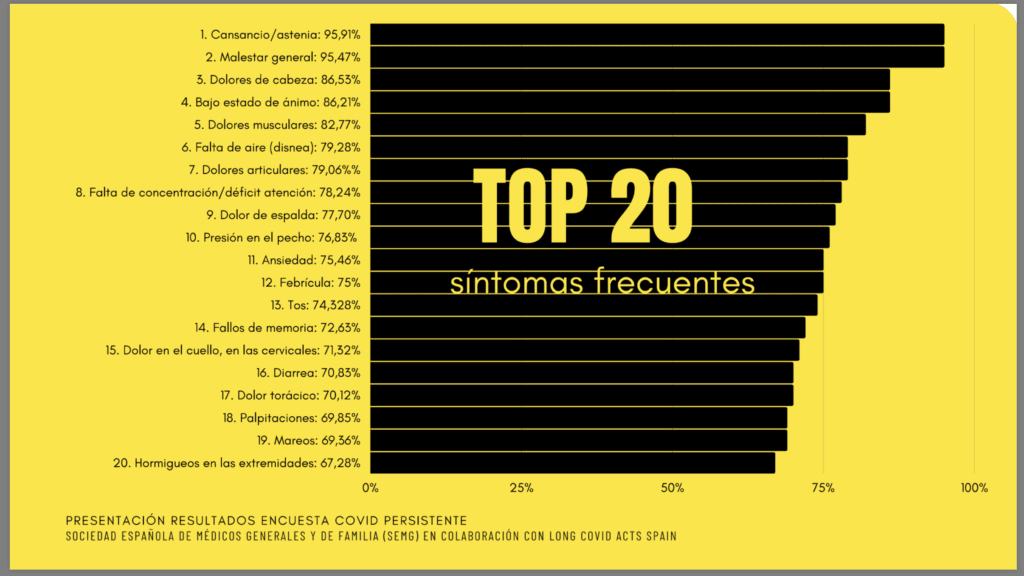
Da un’indagine della Società spagnola di Medicina Generale e Famigliare (SEMG) risulta che su 1834 pazienti clinicamente guariti dalla Covid-19, con un’età media di 43 anni, una % alta continua ad accusare sintomi. L’86% sono sintomi di ordine psicologico e neuropsicologico. Più nello specifico ritroviamo:
- 95,91% stanchezza e astenia
- 86,21% basso stato d’animo
- 78,24% difficoltà di concentrazione
- 75,46% condizioni ansiose
- 72,63% problemi di memoria
- 69,85% palpitazioni
Un altro studio di particolare rilevanza realizzato all’Ospedale di Bergamo, nel quale sono stati coinvolti diversi professionisti tra cui medici e psicologi, ha valutato le possibili sequele psichiche e cognitive nei pazienti Covid-19. Per l’indagine psicologica e neuropsicologica sono stati utilizzati quattro strumenti. Il campione ha coinvolto 767 pazienti in post-dimissione, con un’età media di 63 anni (20-92 anni) di cui il 32,9% donne. Il ricovero è durato in media 10 giorni, 30 per i pazienti in terapia intensiva. Le più importanti comorbilità riscontrate sono state: 22,3% obesità, 21,7% ipertensione, 11,6% diabete, 9,5% malattia coronarica. Di tutto il campione, il 32,9% dei pazienti presi in esame ha accusato complicanze nel corso del ricovero, nello specifico:
- 8,7% di ordine psichiatrico e psicologico
- 8,5% a livello cardiaco
- 7,1% a carico dei polmoni
- 6,1% fenomeni trombotici
Ipotesi patogenetiche della Long-Covid
I meccanismi patogenetici della long-Covid non sono chiari. Attualmente le ipotesi sul correlato fisiologico dei disturbi psichici e neuropsicologici ruota su tre direttrici fisiopatologiche:
- La presenza del virus nei cosiddetti “santuari”
- Una risposta immunitaria sproporzionata
- Un danno biologico da autoimmunità
Il meccanismo che mostra un certo interesse per le sue ipotetiche ricadute psichiche riguarda proprio la risposta immunitaria iper-infiammatoria, la cosiddetta cytokine storm. Questa importante reazione sistemica potrebbe essere alla base nel concorrere a sviluppare i sintomi psicologici e cognitivi. Si ricorda in tal senso che la IL-1 e la IL-6 sono tra le interleuchine più importanti coinvolte nei processi infiammatori. I sintomi psichici e neuropsicologici potrebbero essere dovuti anche ad una neuroinvasione virale e alla già citata proteina S1 che faciliterebbe l’ingresso del patogeno dalla barriera emato-encefalica, analogamente a quanto avviene con la proteina gp120 dell’HIV. Sappiamo, inoltre, che alcuni CoV che presentano neurotropismo possono innescare una risposta pro-infiammatoria attivando i macrofagi, gli astrociti e le cellule della microglia provocando così uno stato neuroinfiammatorio che altera la barriera emato-encefalica e che potrebbe spiegare i disturbi cognitivi in certi pazienti Covid-19.