Origine e sviluppo
Omicron è una variante del virus SARS-CoV-2. Identificata per la prima volta in Sudafrica e Botswana, fu segnalata all’Organizzazione Mondiale della sanità (OMS) il 24 Novembre 2021. Nota anche come B. 1. 1. 529 (da ora in poi B1) possiede una caratteristica principale: non si è sviluppata a partire dalle altre varianti precedenti. Significa che Omicron è diversa dai milioni di genomi di SARS-CoV-2 attualmente sequenziati. Divergenti anche le ipotesi sull’emergenza di Omicron. C’è, tuttavia, accordo sul ruolo chiave che una maggiore sorveglianza e sequenziamento possono rivestire nei Paesi a bassa percentuale di vaccinati. Questi ultimi, infatti, possono essere vere e proprie bombe ad orologeria per lo sviluppo di nuove varianti.
Ottime incubatrici possono essere le popolazioni con condizioni immunocompromesse sproporzionate, come in Africa. Qui, la possibilità di infezioni a lungo termine dal virus SARS-CoV-2 può essere maggiore rispetto a popolazioni sane e/o vaccinate. Sotto la pressione immunitaria ridotta o l’immunosoppressione, le infezioni a lungo termine creano condizioni per l’aumento della probabilità di co-infezioni simultanee con più varianti di SARS-CoV-2. Questo ottimizza la ricombinazione del genoma. La pressione immunitaria ridotta o soppressione immunitaria associata ad una infezione a lungo termine causa l’aumento del turnover delle varianti virali. Di conseguenza, c’è un aumento di mutazioni all’interno della proteina Spike. Finora sono state registrate 37 diverse mutazioni della proteina Spike, di cui 12 situate nella regione del RBD. Questo la rende più imprevedibile nell’alterazione dell’antigenicità e nella capacità di evasione immunitaria.
Quanto è pericolosa Omicron?
Mentre la variante Delta prende di mira il tratto respiratorio inferiore, Omicron è in grado di replicarsi nel tratto respiratorio superiore. Pertanto, sebbene Omicron sembra che porti una malattia meno grave rispetto a Delta, riesce ad acquisire un vantaggio sulla trasmissibilità. A quest’ultimo fattore è associato un rischio di reinfezione di 5,4 volte superiore rispetto a Delta. A destare preoccupazione è proprio la complessità senza precedenti nei suoi modelli di mutazione. Sia la variante B1 che la sotto-variante B2 (differente per circa 40 mutazioni e delezioni da B1) comprendono mutazioni nell’ N-terminale e nel dominio del recettore del gene Spike. Sono le regioni che influenzano la risposta immunitaria. Entrambe le varianti hanno capacità simili nell’evasione immunitaria, che ha come effetto complessivo una minore efficacia del ciclo vaccinale (figura 1 e 2):
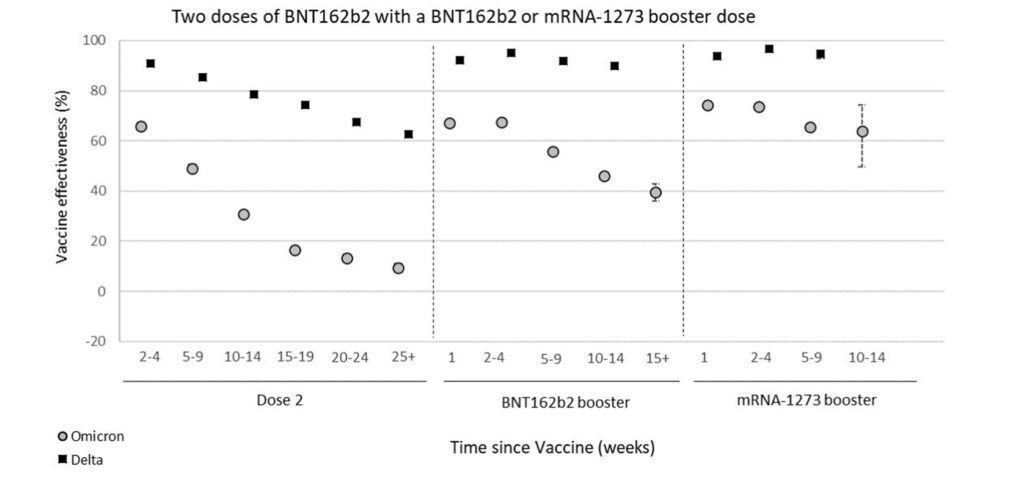
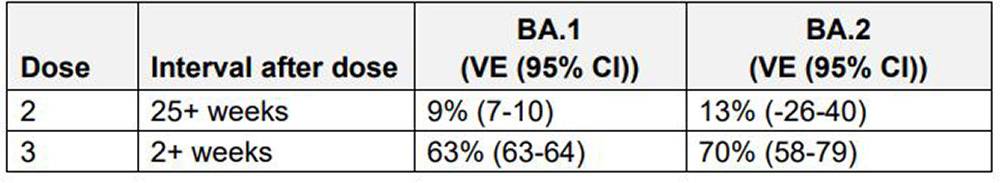
La situazione si ripete per BA2:
Direzioni di studio e terapie
Sono stati effettuati vari tentativi di contatto tra diversi anticorpi neutralizzanti disponibili commercialmente e i siti di legame della proteina Spike di B1. Lo scopo era ottenere una risposta immunitaria più specifica. Gran parte di questi anticorpi ha perso la capacità di neutralizzazione contro Omicron a causa della distruzione dell’epitopo del suo antigene. In questo modo Omicron riesce a darsi alla “fuga” dall’anticorpo. L’efficacia limitata dei vaccini e degli anticorpi neutralizzanti sta spingendo i ricercatori verso nuove direzioni.
Il meccanismo di azione dei farmaci antivirali può riservare delle novità. Infatti, due delle mutazioni del complesso replicasi-trascrittasi di Omicron non sono sfuggite all’azione di farmaci inibitori della RNA polimerasi, per cui questi sono risultati efficaci. I farmaci testati sono remdesivir e molnupiravir. Risultati esigui, ma che possono tracciare una nuova via di esplorazione. In cosa sarebbe diverso il meccanismo di azione dei farmaci antivirali rispetto ai vaccini? Agiscono direttamente sui meccanismi avviati dal gene replicasi del virus.
Inoltre, l’introduzione di peptidi interferenti che interagiscono con la catena dell’RNA virale di Omicron possono dare luogo ad una serie di errori. Uno di questi è l’interruzione della formazione della proteina N (del nucleocapside, ovvero l’involucro che racchiude il virus e che mantiene al suo interno le “istruzioni” indispensabili per la sua replicazione). Il vantaggio sta nel fatto che la proteina N è molto più stabile della proteina Spike, pertanto costituirebbe un bersaglio più semplice per farmaci nanocarrier.
Una nuova strategia contro Omicron
È infatti dall’ambito dell’ingegneria cellulare che giunge un’ulteriore conferma del bersagliamento ottimizzato. Un tentativo di successo è Ingegnerizzare delle vescicole extracellulari (EVs) arricchite con ACE2 solubili (recettore di superficie attraverso il quale SARS-CoV-2 entra nella cellula), ACE2 palmitoilati e anticorpi neutralizzanti. Si è visto che questi veicoli artificiali possono “catturare” il SARS-CoV-2, inibendone il processo di scissione, trascrizione e replicazione. La palmitoilazione consiste nell’attaccamento covalente di acidi grassi all’enzima ACE2, che ne aumentano l’idrofobicità. Questo contribuisce alla sua associazione con la membrana cellulare e, quindi, aumenta la capacità di legarsi al complesso S-RBD di Omicron. Una volta avvenuto il legame, l’enzima arricchito può attivare la sua azione inibente.
Ancora molti sforzi e conferme cliniche devono devono essere raggiunti. Ciononostante, si può dire che quello del drug delivery di farmaci antivirali è un nuovo paradigma che può portare ad aggirare il problema delle varianti.
Fonti
- Cong, S., et. al., 2022. Parallel profiling of antigenicity alteration and immune escape of SARS-CoV-2 Omicron and other variants. Sig Transduct Target There. 7: 42. DOI: https://doi.org/10.1038/s41392-022-00910-6
- Ghosn, J., et. al., 2018. HIV. Lancet. (10148): 685-697. DOI: https://doi.org/10.1016/s0140-6736(18)31311-4
- Mahase, E., 2022. Covid-19: What do we know about omicron sublineages? 376: 358. BMJ. DOI: https://doi.org/10.1136/bmj.o358
- Yao, F., et. al., 2022. SARS-CoV-2 Omicron variant: recent progress and future perspectives. Sig Transduct Target There. 7:141. DOI: https://doi.org/10.1038/s41392-022-00997-x
Crediti Immagini
- Figura 1: UK Health Security Agency
- Figura 2: UK Health Security Agency