Caratteristiche
Il virus del morbillo (measles virus, MeV), isolato per la prima volta nel 1954 da Enders e Peebles appartiene al genere Morbillivirus. Quest’ultimo è incluso nella sottofamiglia Orthoparamyxovirinae (in precedenza chiamata Paramyxovirinae). Tale sottofamiglia fa parte della grande famiglia dei Paramyxoviridae. Questo virus possiede un genoma a RNA lineare monocatenario a polarità negativa, racchiuso da un nucleocapside a simmetria elicoidale, a sua volta circondato da un involucro esterno di natura lipidica (envelope) al quale sono inserite due glicoproteine F e H che svolgono attività fusogena e da recettore virale rispettivamente.
Il genoma di MeV, lungo 15.894 bp, è organizzato in maniera molto simile a quella della maggior parte dei membri della famiglia Paramyxoviridae. All’estremità 3’ (leader) è presente una regione non codificante di 52 nt, a seguire una regione di circa 15.750 nt strutturata in 6 geni e un’altra regione non codificante di 37 nt all’estremità 5’ (trailer). I sei geni codificano per 8 proteine: la nucleoproteina N strettamente associata all’RNA virale grazie al suo dominio N-terminale, la fosfoproteina P (70 kDa) che possiede attività RNA polimerasi-RNA dipendente, le due proteine non strutturali C e V che interferiscono con le vie di segnalazione cellulare mediate da IFN, la proteina M (matrice) che è associata alle proteine F e H, media quindi anche il processo di fusione del virus alla membrana citoplasmatica dell’ospite. La proteina H (78 kDa) funge da recettore virale, può riconoscere e legare il recettore CD150 espresso sulla superficie di linfociti B e T attivati e cellule dendritiche, legarsi al recettore CD46 espresso su cellule epiteliali e del tessuto nervoso o al recettore nectina-4 anch’esso espresso sulla superficie delle cellule epiteliali. La proteina L possiede la stessa attività biologica della proteina P.

Filogenesi
| Phylum | Negarnaviricota |
| Classe | Monjiviricetes |
| Ordine | Mononegavirales |
| Famiglia | Paramyxoviridae |
| Sottofamiglia | Orthoparamyxovirinae |
| Genere | Morbillivirus |
| Specie | Measles Morbillivirus |
Ciclo replicativo del virus
Il ciclo replicativo del virus del morbillo inizia con il legame della proteina H (recettore virale dotato di attività emagglutinante) al recettore posto in superficie sulla membrana cellulare, che come si è detto in precedenza può essere rappresentato da CD150, nectina-4 e CD46. A seguito di questa interazione segue la fusione dell’envelope sulla membrana della cellula ospite, processo mediato dalla proteina F.
Il nucleocapside viene rilasciato nel citoplasma ed in tale contesto il genoma virale inizia ad essere trascritto a partire dall’estremità 3’ per mezzo delle proteine P e L ad attività RNA polimerasica-RNA dipendente. Man mano che la trascrizione dei 6 geni prosegue ne consegue anche un aumento delle concentrazioni di proteine virali e a questo punto viene iniziata la fase di replicazione del genoma virale, sintetizzando sempre ad opera delle proteine P e L un filamento di RNA a polarità positiva. Questo viene utilizzato come copia per la sintesi di molte copie di RNA a polarità negativa. La nucleoproteina si associa alle nuove molecole di RNA, la proteina M va a ricoprire il nucleocapside indirizzandolo verso la membrana cellulare per il legame con le proteine F e H. L’ultimo passaggio del ciclo replicativo è la fuoriuscita per gemmazione del virione maturo.
Patogenesi
Il morbillo è una malattia esantematica altamente infettiva caratterizzata da febbre, sintomi respiratori e rash maculo-papulare. L’ingresso del virus del morbillo nell’organismo avviene attraverso il tratto respiratorio o tramite la congiuntiva per mezzo di goccioline aerodiffuse (droplet). MeV si lega quindi ai recettori CD150 di cellule linfoidi e mieloidi dell’epitelio respiratorio o nel caso della congiuntiva ai recettori esposti in superficie di tali cellule.
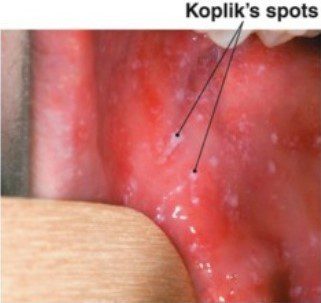
Dopo un’iniziale fase di replicazione locale, diffonde agli organi linfoidi regionali nei quali si ha una seconda e massiccia replicazione. Da qui, in seguito a una prima fase viremica, il virus raggiunge il sistema reticoloendoteliale, dove si replica dando inizio a una seconda fase viremica che lo dissemina negli epiteli più superficiali del corpo, inclusa epidermide. La replicazione virale nel tessuto linfoide causa la formazione di caratteristiche cellule giganti multinucleate con inclusioni intracitoplasmatiche e intranucleari dette cellule giganti di Warthin-Finkeldey. L’infezione è quasi sempre sintomatica, ha un periodo di incubazione di 7-13 giorni e si manifesta clinicamente con una fase prodromica di 3-5 giorni e una fase eruttiva di 5-8 giorni. La fase prodromica è caratterizzata da febbre, tosse, congestione nasale e congiuntivite. Un segno caratteristico della malattia sono le macchie di Koplik (fig.2) ovvero, piccole ulcerazioni biancastre che compaiono a livello della mucosa orale e che scompaiono circa 2 giorni prima della comparsa dell’eruzione cutanea.
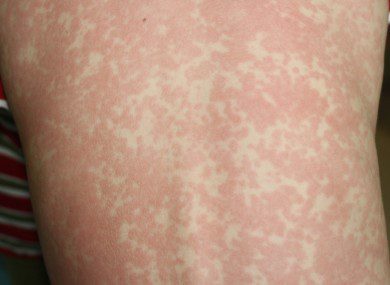
L’eruzione cutanea o esantema (fig.3) è caratterizzata da piccole maculo-papule che, in genere confluiscono in lesioni uniche e si diffonde dalla testa al torace e a seguire nel resto del corpo. Questa condizione, accompagnata da febbre, si risolve in 5 o 7 giorni a seguito dell’attivazione di una risposta immunitaria specifica contro il MeV. Le complicazioni del morbillo sono numerose e spesso in alcuni casi molto gravi. L’otite media si può osservare nel 7-9% dei casi, la polmonite causata anche da superinfezioni batteriche (Streptococcus pneumoniae, Haemophilus influenzae) in una percentuale compresa tra 1-6%. Le più gravi invece sono l’encefalite dovuta all’infezione diretta del virus nei neuroni e si sviluppa 2-6 giorni dopo l’insorgenza dell’esantema, l’encefalomielite acuta disseminata (ADEM) che si manifesta dopo circa 2 settimane dall’infezione e la panencefalite sclerosante subacuta (PESS), una malattia che insorge con convulsioni, disturbi cognitivi e irrigidimento muscolare anche dopo anni di distanza dall’infezione primaria.
Aspetti epidemiologici e vaccinazione
Sebbene da circa 50 anni sia presente un vaccino sicuro e efficace, il morbillo rimane, a livello globale, una delle principali cause di morte in soggetti con età inferiore ai 5 anni.
Nel 2015 ad esempio, tale malattia ha causato 134.200 decessi e più del 75% delle morti è avvenuta in Nigeria, Etiopia, Indonesia e Pakistan. Sempre in quell’anno però circa l’85% dei bambini nel mondo ha ricevuto, attraverso i servizi sanitari primari, una dose di vaccino entro il primo anno di età (nel 2000 era il 79%). Grazie alla vaccinazione, dal 2000 al 2015, l’incidenza del morbillo è diminuita del 75%, da 146 a 36 casi per milione di abitanti ed è stato registrato un calo del 79% della mortalità causata da questa malattia (passando da 651.600 decessi stimati nel 2000 a 134.200 nel 2015). La stabilità antigenica e l’esistenza di un solo sierotipo ha permesso di sviluppare un vaccino efficace e sicuro.
Il vaccino utilizzato è vivo attenuato ed è stato sviluppato negli anni ’60 del secolo scorso e successivamente migliorato. Inizialmente presente in forma monovalente, è stato sostituito dal vaccino combinato contro morbillo, parotite e rosolia (MPR). In Italia il vaccino non è obbligatorio ma fortemente raccomandato, una dose viene somministrata tra il 12° e il 15° mese di età e una seconda in età prescolare, 5°-6° anno. Solo una piccola percentuale di soggetti entro la prima settimana dalla vaccinazione riscontra effetti indesiderati come febbre e rossore nel sito di iniezione.
Si ringrazia Diego Piacentini per il contributo
Fonti
- S. Aref, K. Bailey, A. Fielding, 2016, Measles to rescue: a review of oncolytic measles virus.
- Y. Jiang, Y. Qin, M. Chen, 2016, Host-pathogen interactions in measles virus replication and anti-viral immunity.
- Laksono, de Vries et all., 2016, Measles virus host invasion and pathogenesis.
- S. Qi, C.Y. Jia, Y. Yin, 2015, Measles.
- L. Tannous, G. Barlow, N.Metcalfe, 2014, A short clinical review of vaccination against measles.
- www.epicentro.iss.it