Caratteristiche
Pyrococcus furiosus (Fig. 1) è una specie estremofila appartenente al dominio degli Archea. Questo microrganismo è stato descritto per la prima volta, più di trent’anni fa, da Karl Stetter e collaboratori, i quali gli assegnarono questo curioso nome. Il termine Pirococco deriva dal greco e significa letteralmente “sfera di fuoco” per richiamare la sua caratteristica forma tondeggiante e la capacità di crescere a temperature molto elevate, superiori ai 100 °C. L’eccezionale velocità di duplicazione e la sua vivace motilità, invece, rendono ragione del termine latino furiosus che significa per l’appunto impetuoso/rapido.

È uno dei primi ipertermofili ad essere studiato esaustivamente dagli scienziati, in quanto rappresenta un importante fonte di enzimi e proteine altamente resistenti agli shock termici e alle radiazioni. Particolarmente degno di nota è anche il fatto che alcuni dei suoi enzimi (nello specifico le aldeidi ossidoreduttasi, AOR) necessitano del tungsteno come cofattore, un elemento piuttosto raro nelle molecole biologiche.
Le peculiari caratteristiche strutturali, metaboliche ed enzimatiche, la rapidità dei tempi di replicazione, l’abilità a prosperare a temperature elevatissime, e la capacità di adattarsi facilmente a manipolazioni sperimentali, rendono P. furiosus un organismo modello, tanto da essere considerato l’Escherichia coli degli ipertermofili.
Filogenesi
| DOMINIO | Archaea |
| REGNO | Euryarchaeota |
| PYLUM | Thermococci |
| ORDINE | Thermococcales |
| FAMIGLIA | Thermococcaceae |
| GENERE | Pyrococcus |
| SPECIE | Pyrococcus furiosus |
Genoma e metabolismo
P. furiosus possiede un singolo cromosoma circolare. Il suo genoma, completamente sequenziato nel 2001 presso l’Istituto Biotecnologico dell’Università del Maryland e avente dimensioni pari a 1,91 Mb, ha rivelato un contenuto di guanine (G) e citosine ( C ) pari al 40,8%, e la presenza di 2.225 geni codificanti per 2.122 proteine.
Tuttavia, successivamente a questo studio, è ben presto emerso che il genoma di P. furiosus risulta essere particolarmente suscettibile a riarrangiamenti, soprattutto a causa della presenza di sequenze di inserzione (IS). La variabilità genomica può essere osservata sia nell’habitat naturale ma anche nei ceppi coltivati in laboratorio. Questa scoperta, unitamente allo sviluppo di nuove e sempre più raffinate tecniche di sequenziamento e ai progressi in ambito bioinformatico, hanno portato un gruppo di ricercatori a sequenziare de novo il genoma di questo microrganismo.
Allo stato attuale, e a causa di una delezione verificatasi nel tempo, il genoma di P. furiosus risulta essere di dimensioni leggermente inferiori (1.889.914 bp), rispetto a quello analizzato in precedenza, ed ospita un minor numero di geni (2.035). Tra questi, la maggior parte codificano per enzimi coinvolti nel ciclo metabolico di tali organismi, il che li rende in grado di sopravvivere a condizioni ambientali diverse poiché riescono a trasportare e soprattutto a metabolizzare una vasta gamma di composti organici.
Da un punto di vista metabolico, P. furiosus è un organismo eterotrofo. E’ davvero unico nel suo genere in quanto, a differenza di altri ipertermofili, predilige l’utilizzo sia di peptidi che di carboidrati come fonti di carbonio. La sua crescita, inoltre, può avvenire sia in presenza che in assenza di zolfo elementare (S0). I prodotti metabolici che si formano sono rappresentati da acetato, alanina, CO2 e H2, ma anche H2S qualora sia presente lo zolfo. La via glicolitica insolita, utilizzata da questo microrganismo, è stata ampiamente studiata e funge tutt’ora da modello per la comprensione del percorso Embden-Meyerhof modificato, generalmente presente negli Archea.
Anche il sistema respiratorio appare singolare e allo stesso tempo sorprendentemente semplice. Nello specifico il trasferimento di protoni, per formare idrogeno gassoso, genera un gradiente elettrochimico attraverso la membrana cellulare, fondamentale per guidare la sintesi della molecola energetica ATP. Tale sistema potrebbe rappresentare il precursore degli attuali sistemi respiratori presenti negli organismi più evoluti.
Immagini al microscopio
Morfologicamente gli organismi di questa specie appaiono di forma coccoide con un diametro compreso tra gli 0,8 e i 2 µm ed esibiscono una serie di flagelli apicali (Fig. 2). Ogni cellula possiede una cinquantina di flagelli ciascuno dei quali è lungo all’incirca 7 μm e spesso 7 nm. In prossimità dell’origine dei flagelli è generalmente presente un corpo simile a un granulo denso di elettroni di larghezza pari a 1 μm.
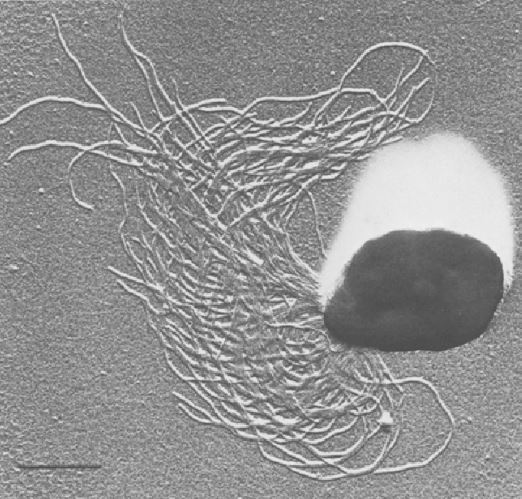
Diversi studi hanno dimostrato che i flagelli, non solo, sono fondamentali per la motilità ma vengono utilizzati da questi organismi per stabilire connessioni cellula-cellula e per aderire a superfici solide (Fig. 3). In particolare le connessioni stabilite potrebbero rappresentare un prerequisito fondamentale per consentire il trasferimento genico tra le cellule di P. furiosus ed altre specie. Tuttavia, sono necessari ulteriori studi per confermare questa ipotesi.
Oltre a ciò, le cellule appaiono circondate da un involucro glicoproteico di circa 50 nm di spessore; quest’ultimo può essere distinto in una regione interna ad alto contrasto, spessa circa 16 nm, e una regione esterna debolmente contrastata.

Ecologia
P. furiosus è un organismo acquatico anaerobio presente generalmente in prossimità di sorgenti termali ricche di zolfo, dove le temperature raggiungono e spesso superano i 90 °C. E’ stato isolato per la prima volta nel 1986 sull’isola di Vulcano nell’arcipelago delle isole Eolie, in Sicilia (Fig. 4)

Il suo optimum di temperatura è intorno ai 120 °C ed è in grado di tollerare variazioni di pH in un range tra 5 e 9 (con un optimum di crescita a pH 7). In condizioni ottimali si duplica in 37 minuti che è il tempo più breve tra gli Archea fino ad ora conosciuti.
Nonostante P. furiosus sia da sempre considerato un microrganismo anerobico esigente, mostra una sorprendente capacità di tollerare l’ossigeno, un elemento che dovrebbe essere estremamente tossico per la sua stessa sopravvivenza. Come supportato da molti studi ciò sembra essere dovuto alla presenza di diversi geni, espressi costitutivamente, che renderebbero questo microrganismo capace di rispondere prontamente ai danni causati dall’esposizione alle specie reattive dell’ossigeno (ROS). Questa nozione è coerente con l’idea che nei loro ambienti naturali, organismi ipertermofili come P. furiosus sono esposti improvvisamente all’O2, e ciò avviene quando l’acqua di mare fresca e ossigenata si mescola con il fluido di sfiato idrotermale.
Tra tutte le proteine di P. furiosus implicate nella risposta allo stress ossidativo, particolarmente importante ed oggetto di molti studi, è la proteina nota come superossido reduttasi (SOR). Nello specifico il microrganismo impiega questo enzima per rimuovere il superossido mediante una reazione che riduce l’O2.
Metodi di identificazione
P. furiosus può essere coltivato in laboratorio, utilizzando il terreno di coltura SME, arricchito con estratto di lievito, peptone o carboidrati. Dopo 24h di incubazione, gli organismi diventano visibili.
Le colonie pure possono essere ottenute mediante ripetute diluizioni seriali, o in alternativa effettuando lo striscio su terreno agarizzato. Dopo circa 1 settimana di incubazione a 70 °C, le colonie risultano ben visibili e appaiono lisce, di colore bianco e con un diametro di 0,5 mm.
Applicazioni industriali
Come accennato in precedenza, P. furiosus rappresenta una fonte di enzimi termostabili con potenziali applicazioni in vari processi industriali. Ad esempio, di notevole interesse è la sua DNA polimerasi, nota come Pfu-DNA, un enzima indispensabile per il processo replicativo, e dotata di un’attività esonucleasica 3′ ‐ 5′. In virtù di questa capacità di correzione di bozze e dell’elevata stabilità termica questo enzima è comunemente utilizzato in migliaia di reazioni di PCR in tutto il mondo. Inoltre, una delle speciali caratteristiche native di P. furiosus è che ospita un’idrogenasi solubile (SHI), un enzima in grado di usare idrogeno gassoso per la riduzione del NAD procurando così una fornitura costante di potenziale riducente per scopi biosintetici.
Oltre alle sue già eccellenti proprietà intrinseche, questo microrganismo, in seguito a manipolazioni genetiche, diventa in grado di esprimere geni provenienti da batteri o altri archea acquisendo così nuove capacità. A riprova di ciò alcuni ricercatori della University of Georgia hanno pubblicato una lavoro che prevede l’utilizzo di tale organismo, in una forma mutata per produrre carburante (l’acido 3-idrossipropanoico) a partire dall’anidride carbonica atmosferica. Nel dettaglio cinque geni (codificanti per proteine essenziali per la fissazione del carbonio) del microrganismo Metallosphaera sedula sono stati inseriti in ceppi di P. furiosus conferendogli la capacità di incorporare e metabolizzare l’anidride carbonica.
Uno dei vantaggi di questo procedimento, che non manca ovviamente di diversi limiti e imperfezioni, è quello di permettere di ottenere dall’acido estratto un carburante contenente la stessa quantità di anidride carbonica utilizzata per crearlo, rendendolo un’alternativa molto più pulita di benzina, carbone e petrolio.
In un altro lavoro, è stato dimostrato come l’espressione eterologa del gene adhA, isolato da un batterio termofilo (appartenente al genere Thermoanaerobacter), in ceppi P. furiosus, conferisca loro la capacità di produrre notevoli quantità di etanolo. Questo è di notevole importanza in quanto, allo stato attuale, l’etanolo rappresenta di gran lunga il biocarburante più comunemente utilizzato.
In conclusione, l’espressione di geni di origine eterologa, la glicolisi atipica, l’insolita chimica redox e la presenza di enzimi termostabili e contenenti tungsteno, rendono P. furiosus il candidato ideale per la produzione di sostanze chimiche e combustibili.
Livia Sabetta
Fonti
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6640164/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5658583/
- https://link.springer.com/article/10.1007/BF00413027
- https://jb.asm.org/content/188/19/6915
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5658578/
- https://microbewiki.kenyon.edu/index.php/Pyrococcus_furiosus
Crediti immagini
- immagine in evidenza – https://www.popsci.com/science/article/2013-03/scientists-are-engineering-volcanic-microorganisms-chew-co2-spit-back-fuel/
- Fig. 1 – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5658583/figure/mbt212695-fig-0001/
- Fig. 2 – https://www.semanticscholar.org/paper/Pyrococcus-furiosus-sp.-nov.-represents-a-novel-of-Fiala-Stetter/d41eeda7a7902d0c775f2bf69a5a154fa911459b/figure/2
- Fig. 3 – https://jb.asm.org/content/188/19/6915
- Fig.4 – https://www.ansa.it/scienza/notizie/rubriche/energia/2012/04/18/Batteri-estremi-candidati-fabbriche-biocarburanti_6735428.html