Acinetobacter è una parola composta che deriva dal greco α + κίνητο + βακτηρ(ία), che significa bastoncino non mobile. Acinetobacter calcoaceticus (Fig. 1) è una specie di batteri del genere Acinetobacter e fa parte della normale flora del corpo umano. E’ presente nell’acqua e nel suolo, sulla cute umana e animale come commensale. Può essere un agente patogeno di infezioni opportunistiche in pazienti immunocompromessi o immunodepressi.

Caratteristiche
Beijerinck è stato il primo a descrivere Acinetobacter calcoaceticus col nome di micrococcus calco-aceticus nel 1911. In seguito, è stato studiato a più riprese e sono state indagate sempre più le caratteristiche di questo microrganismo non patogeno per l’uomo ma molto interessante per la sua similitudine con Acinetobacter baumannii, col quale forma un complesso particolarmente problematico nelle infezioni ospedaliere, in quanto resistente alla maggior parte degli antibiotici utilizzabili. Il complesso, identificato tale per la vicinanza genetica dei due ceppi batterici, viene nominato ABC perché sono riprese le iniziali di Acinetobacter-baumannii-calcoaceticus.
Se siete curiosi di ricostruire la sua storia potete digitare il nome nel database https://www.ncbi.nlm.nih.gov ovvero il National Library of Medicine, uno collettori di informazioni più affidabili per ricerche di tipo biologico e biomedico.

Le specie del genere Acinetobacter sono bacilli Gram-negativi strettamente aerobi, non fermentativi. Mostrano principalmente una morfologia coccobacillare su agar non selettivo. La maggior parte dei ceppi di Acinetobacter, ad eccezione di alcuni ceppi di Acinetobacter lwoffii, crescono bene su agar MacConkey (senza sale). Sebbene ufficialmente classificati come non fermentanti il lattosio, sono spesso parzialmente fermentanti il lattosio quando vengono coltivati su agar MacConkey. Sono ossidasi-negativi, catalasi-positivi, indolo-negativi, non mobili e generalmente nitrati-negativi.
Filogenesi
| Dominio | Bacteria |
| Regno | Proteobacteria |
| Phylum | Gammaproteobacteria |
| Ordine | Pseudomonadales |
| Famiglia | Moraxellaceae |
| Genere | Acinetobacter |
| Specie | Acinetobacter calcoaceticus |
Perché è importate la ricerca di agenti non patogeni?
Quindi, studiare e comprendere Acinetobacter calcoaceticus è importante perché non è un microrganismo patogeno opportunista come Acinetobacter baumannii e può essere maneggiato più tranquillamente in laboratorio senza però abbassare l’attenzione perché con il suo fratello, oltre a condividere lo stesso profilo di resistenze agli antibiotici, forma un complesso.
Identificazione del complesso Acinetobacter-baumannii-calcoaceticus
Le colonie del complesso Acinetobacter calcoaceticus – acinetobacter baumannii, dopo incubazione a 37°C, mostrano un aspetto liscio, rotondo e mucoso (Video 1). Poiché l’identificazione di routine nel laboratorio di microbiologia clinica non è ancora possibile, gli isolati di Acinetobacter sono divisi e raggruppati in quattro gruppi principali:
- complesso Acinetobacter calcoaceticus-baumannii: glucosio ossidante e non emolitico;
- Acinetobacter baumannii, identificato mediante tipizzazione OXA-51(enzimi β-lattamasi);
- Acinetobacter lwoffii: glucosio-negativo, non emolitico;
- Acinetobacter haemolyticus: emolitico.
L’Acinetobacter baumannii è raggruppato con altre specie fenotipicamente simili in quello che è diventato comunemente noto come il complesso ACB che oltre ad A. calcoaceticus comprende le specie A. pittii e A. nosocomialis. L’ecologia e la patologia della maggior parte di queste specie non sono ben comprese, principalmente perché le tecniche fenotipiche e biochimiche non bastano a discriminare le specie batteriche. Quindi solo con tecniche genomiche sarà possibile studiare approfonditamente queste specie e sottospecie. Obiettivi attuali della ricerca microbiologica.
Novità sulle resistenze a antibiotici
Infatti i metodi genotipici, dalla PCR al sequenziamento, hanno notevolmente migliorato capacità di identificare il complesso ACB. Ciò ha portato all’implementazione di programmi di controllo delle infezioni. Dagli anni ’90, la resistenza antimicrobica (AMR) è aumentata notevolmente tra ABC. La diffusione globale di ceppi ABC multiresistenti (MDR) riflette la diffusione di alcuni ceppi tra gli ospedali, regioni geografiche e continenti. L’uso eccessivo di antibiotici amplifica questa diffusione. Molti isolati sono resistenti a tutti gli antimicrobici eccetto il colistimetato di sodio e le tetracicline (minociclina o tigeciclina) emalcune infezioni non sono curabili con gli agenti antimicrobici esistenti. L’AMR rappresenta una seria minaccia per trattare o prevenire efficacemente le infezioni da ABC. Una terapia ottimale richiederà probabilmente una terapia antimicrobica combinata con gli antibiotici esistenti, nonché lo sviluppo di nuove classi di antibiotici. Le specie di Acinetobacter sono intrinsecamente resistenti a molteplici antimicrobici e hanno una notevole capacità di acquisire nuovi determinanti di resistenza tramite plasmidi, trasposoni, integroni e isole di resistenza.
Enzimi β-lattamasi
Gli enzimi beta-lattamasi che vengono prodotti dalla specie Acinetobacter sono in grado di idrolizzare l’anello beta-lattamico presente nella struttura di molti antibiotici e renderli così inattivi. In un recente studio sono state classificate le specie di Acinetobacter fin’ora conosciute, con particolare attenzione a Acintobacter calcoaceticus, in base al tipo di beta-lattamasi prodotta, se questa avesse modifiche aminoacidiche e se tali variazioni influissero sull’attività dell’enzima e quindi sulla possibilità di dare maggiore o minore influenza sulla resistenza agli antibiotici. In particolare è stata individuata una beta-lattamasi OXA-822 da un isolato clinico di A. calcoaceticus che ha mostrato attività di penicillinasi e carbapenemasi anche se solo in vitro, concertazioni minime inibitorie (MIC) elevate in diverse specie e ridotta suscettibilità ai carbapenemi in A. baumannii in vivo.
Metalli pesanti e antibiotici
In questo mondo interconnesso e sempre più inquinato poi possiamo apprendere come in Pakistan, paese che ha avuto una rapita urbanizzazione, uno studio sulle acque reflue ha riportato la presenza di un ceppo di Acinetobacter calcoaceticus STP14 con sequenziamento del gene dell’RNA ribosomale 16S. Questo ceppo presentava resistenza a diversi metalli come mercurio, cobalto, rame, nichel, piombo e cadmio. Tra questi metalli, il batterio ha mostrato la massima resistenza al cadmio in concentrazione fino a 1200 mg/L. Il test di suscettibilità antimicrobica del ceppo STP14 di A. calcoaceticus ha mostrato poi coreesistenza a tutti gli antibiotici testati ad eccezione della tigeciclina e del cloramfenicolo per i quali è stata osservata rispettivamente una zona di inibizione di 16 ± 1- e 15 ± 1 mm.
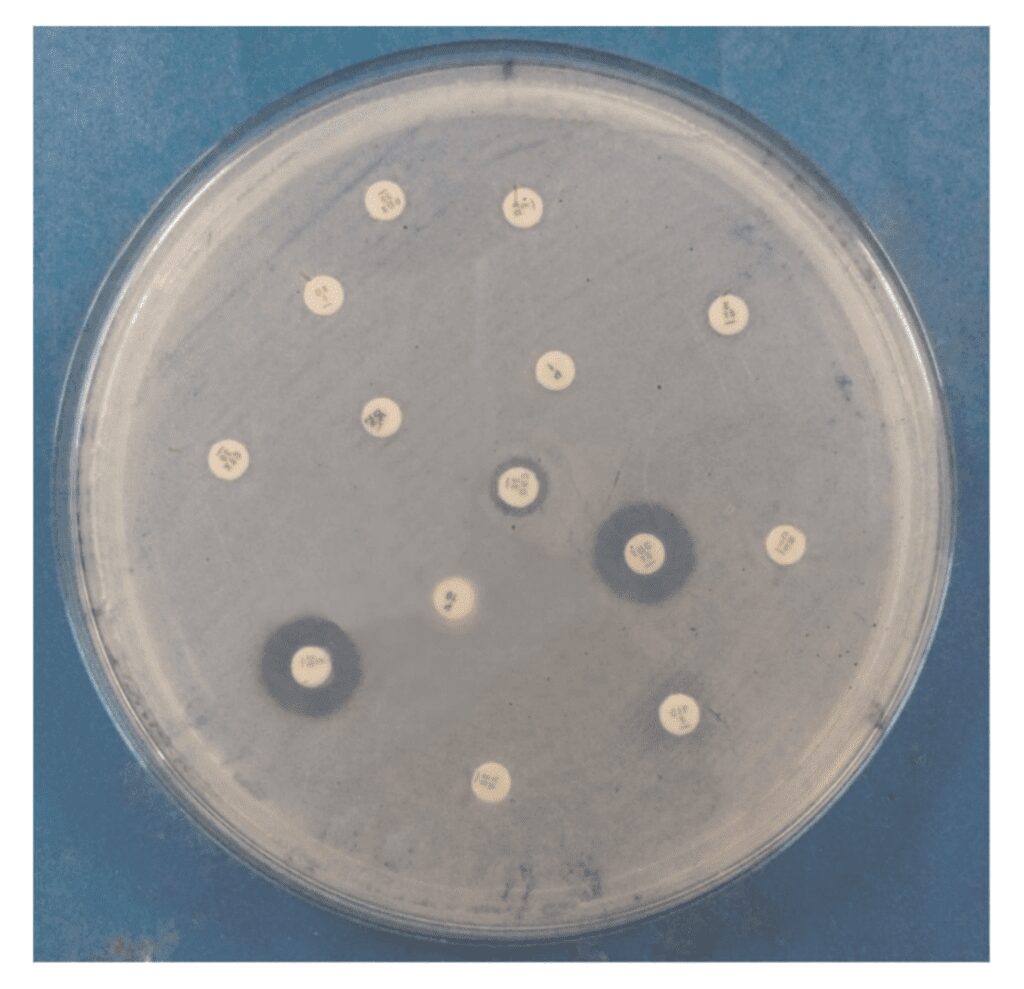
calcoaceticus STP14. Viene mostrata la chiara zona di inibizione
intorno a tigeciclina e cloramfenicolo [fonte https://pubmed.ncbi.nlm.nih.gov/33491793/]
Lo stress cellulare causato dai metalli potrebbe essere un elemento di selezione di batteri che già sono resistenti agli antibiotici. Da qui sorge necessaria una riflessione non solo sul trattamento dell’essere umano con debiti farmaci ma del trattamento dell’ambiente dove l’essere umano vive.
Cosa stiamo facendo?
Secondo il rapporto del 2019 dell’Epicentro dell’Istituto Superiore di Sanità in Italia, per l’Acinetobater spp. si sono riscontati valori di resistenza e di multi-resistenza particolarmente elevati e in ulteriore aumento nell’ultimo anno. Nel 2020 la percentuale più alta di resistenza si è osservata per i fluorochinoloni (ciprofloxacina, levofloxacina, 83,4%), seguita dagli aminoglicosidi (gentamicina, amikacina, 82,1%), e dai carbapenemi (imipenem, meropenem, 80,8%). Nel marzo del 2022 è stato implementato dell’Istituto Superiore di Sanità un nuovo protocollo per la sorveglianza sulle antibiotico resistenze, visionabile al seguente link: https://www.epicentro.iss.it/antibiotico-resistenza/aggiornamenti
Fonti
- https://en.wikipedia.org/wiki/Acinetobacter_calcoaceticus
- https://en.wikipedia.org/wiki/Acinetobacter
- https://www.gbif.org/species/3223263
- https://pubmed.ncbi.nlm.nih.gov/35884232/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3993105/#B1
- https://journals.asm.org/doi/10.1128/JCM.01021-06?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
- https://en.wikipedia.org/wiki/Acinetobacter_lwoffii
- https://www.microbiologiaitalia.it/didattica/le-colonie-batteriche/
- https://www.youtube.com/watch?v=iqZAGwIsles
- https://it.wikipedia.org/wiki/Martinus_Willem_Beijerinck
- https://www.researchgate.net/figure/Colonies-of-Acinetobacter-calcoaceticus-grown-on-the-natural-zeolite-particles_fig3_288655383
- https://www.thieme-connect.com/products/ejournals/abstract/10.1055/s-0041-1741019
- https://www.epicentro.iss.it/antibiotico-resistenza/ar-iss-rapporto-acinetobacter-species
Fonti immagini
- https://phil.cdc.gov/Details.aspx?pid=1260
- https://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?mode=Info&id=471
- https://youtu.be/E0za0f7dXoM
- https://pubmed.ncbi.nlm.nih.gov/33491793/