Micro vescicole batteriche modificate per il trattamento di cellule tumorali
Cos’è la chemioterapia?
La chemioterapia costituisce la terapia medica che si serve di composti chimici di sintesi a scopo antimicrobico. Specificamente, un chemioterapico ha come effetto terapeutico atteso la distruzione di una popolazione cellulare. Pertanto, in tale ambito, si cercano molecole dotate del massimo livello di selettività di azione. Altra caratteristica molto importante è l’efficacia; in particolare, un chemioterapico è tanto più efficace quanto maggiori sono le differenze biologiche che sussistono tra le cellule bersaglio e quelle dell’organismo ospite. A tal proposito, i batteri con le loro caratteristiche naturali, possono venirci in aiuto e costituire degli improbabili alleati molto preziosi.
Outer membrane vescicles (OMVs)
I batteri producono peculiari vescicole di membrana esterna, chiamate outer membrane vescicle (OMVs). Specificamente, lo studio di queste vescicole cominciò per curiosità come fenomeno di base dei batteri e successivamente n’è stata trovata applicazione in ambito chemioterapico nella trattazione di particolari tipi di tumori. In particolare, osservando la doppia membrana di un batterio gram– è possibile apprezzare che queste vescicole si presentano come vere e proprie formazioni sferiche che, una volta formatesi, si distaccano completamente dalla superficie batterica mediante un meccanismo non ancora del tutto noto.
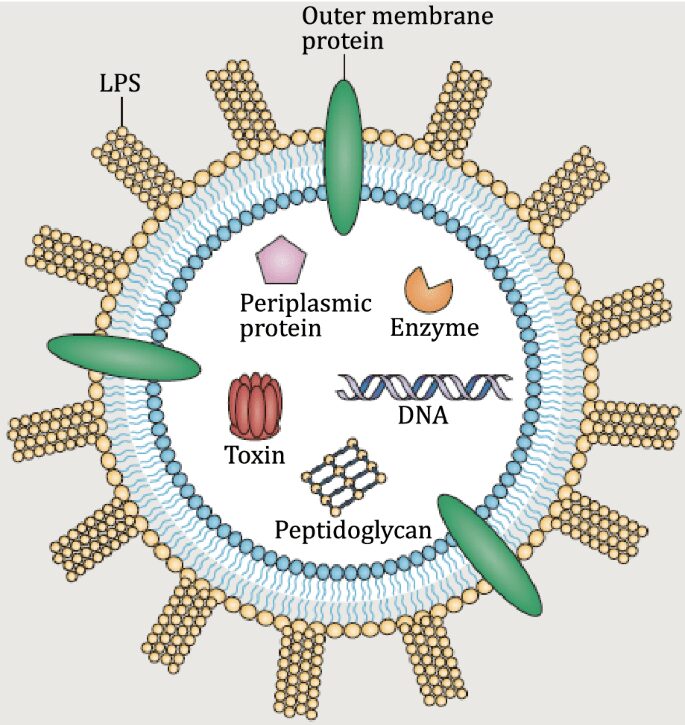
Anche la loro funzione non è del tutto chiara e potrebbe essere collegata ad una nuova modalità con cui i batteri possono scambiarsi materiale genetico o intere proteine. Difatti, queste vescicole membranose possono poi andare a fondersi con la superficie di altri batteri nell’ambiente circostante.
Selettività
A tal proposito, alcuni ricercatori hanno pensato di modificare il batterio produttore di OMVs così da poter far esprimere sulla sua membrana esterna una particolare proteina, chiamata “affibody” (il cui nome deriva dall’insieme delle parole “antibody“, ovvero anticorpo, ed “affinity“, cioè affinità). Dunque, parliamo di una proteina costruita ad hoc per avere un’elevata affinità nei confronti di bersagli specifici. In particolare, l’affibody prodotta presenta elevata specificità nei confronti di HER2, un recettore transmembrana altamente espresso nelle cellule tumorali di tumori al seno, alle ghiandole salivari, allo stomaco ed alle ovaie. Ad ogni modo, una volta distribuite nell’organismo, queste vescicole andranno a localizzarsi selettivamente solo a livello delle cellule tumorali che esprimono HER2 sulla loro superficie.
Efficacia
A questo punto, per rendere le OMVs che esprimono l’affibody anche capaci di inibire la replicazione delle cellule tumorali, quindi, anche competenti, si è ricorso ad una tecnica basata sulla scoperta dell’RNA interfering.
In particolare, fornendo ad una cellula un oligonucleotide complementare (overlapping) ad un mRNA che deve esprimersi, si avrà che questa sequenza complementare (overlapping), andrà a localizzarsi a livello del sito di legame del ribosoma sull’mRNA in questione, rendendolo intraducibile. Questo perché si viene a creare un fenomeno d’interferenza dovuto proprio alla formazione di questo duplex di siRNA o short interfering RNA.
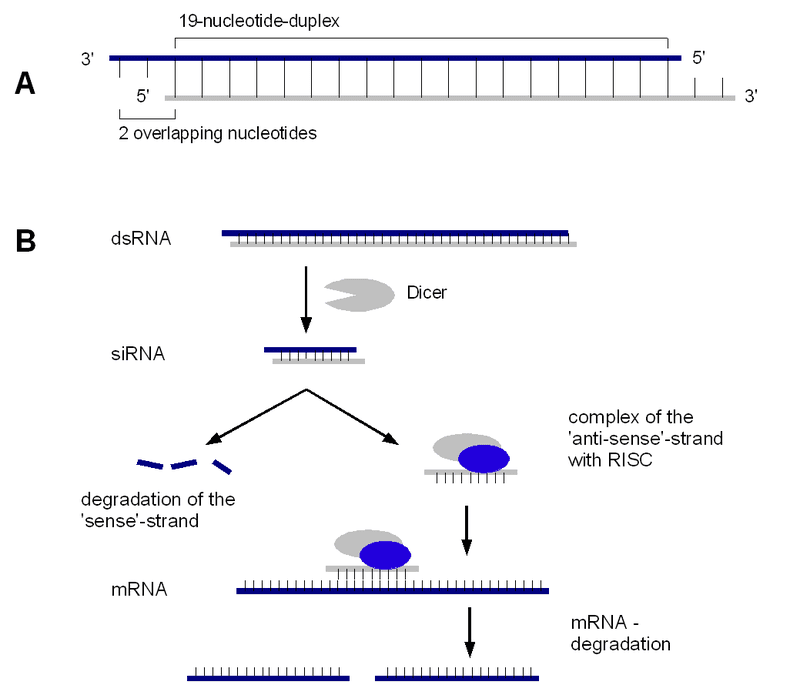
Pertanto, qualora il messaggero in questione codifichi per una proteina indispensabile per la sopravvivenza di una determinata cellula, si provoca la morte della stessa. Quindi, mettendo insieme il concetto di raggiungere specificamente un certo tipo di cellula mediante le OMVs esprimenti l’affibody e quello di uccidere la suddetta tipologia di cellula attraverso RNA interfering, si è immaginato un possibile approccio terapeutico per tumori specifici che esprimono il recettore HER2.
Studi
Generate le OMVs, si è andati ad arricchirle di molecole di siRNA attraverso l’elettroporazione. Pertanto, una miscela di OMVs e siRNA è stata sottoposta ad un campo elettrico ad alto voltaggio per alcuni millisecondi. In questo modo, i siRNA attraverseranno i microcorpi formatisi sulla superficie delle OMVs. Quindi, si avrà l’ingresso di un certo quantitativo di molecole di siRNA che si accumuleranno all’interno del lume delle vescicole. Pertanto, tali vescicole saranno sia selettive che efficaci, in quanto in superficie avranno l’affibody che riconosce specificamente l’HER2 delle cellule tumorali e soprattutto, una volta che è avvenuta quest’interazione, la fusione delle vescicole con la membrana delle cellule tumorali libererà al loro interno le molecole di siRNA. Una volta penetrata nella cellula tumorale, la molecola di siRNA verrà opportunamente modificata e andrà ad interagire con l’RNA bersaglio che presenta una sequenza complementare al siRNA utilizzato. Successivamente, possono verificarsi due eventi:
- Si crea un parziale double-strand che maschera il sito d’interazione del ribosoma sull’mRNA, bloccandone la traducibilità;
- sui siRNA vengono inseriti opportuni segnali di attrazione per delle RNAasi che andranno a degradare completamente l’mRNA.
In entrambi i casi, si avrà la perdita del messaggero bersaglio e se ciò renderà quella cellula incapace di produrre un fattore importante per la sua sopravvivenza o un certo inibitore, ad esempio, dell’apoptosi cellulare, la cellula in questione morirà.
Risultati
Ad oggi, questa tecnica è stata applicata solo sui topi. In particolare, nei topi considerati in questo studio, si è stimolata la produzione di un tumore primitivo mammario a livello della cute. Dunque, al tempo 0, a queste cavie sono state somministrate 4 tipi di preparazioni:
- tampone fosfato salino (PBS);
- PBS in aggiunta a semplice siRNA libero, non inserito nelle OMVs (FreesiRNA);
- PBS in aggiunta a OMVs trasformate per elettroporazione con siRNA, che però non esprimono l’affibody per HER2 (OMVssiRNA );
- infine, PBS in aggiunta a OMVs trasformate per elettroporazione con siRNA, che esprimono l’affibody per HER2 (AffiHER2OMVsiRNA ).
Resoconto dello studio

Seguendo graficamente i risultati di tale studio, è possibile apprezzare che al tempo 0 il volume della massa tumorale è uguale in tutte le cavie. Man mano che si va avanti nel tempo, si nota che i topi trattati esclusivamente con il PBS presentano un incremento massimo della massa tumorale. Analogamente, il caso relativo alla sola somministrazione di siRNA. Ad un livello intermedio di comportamento, invece, si osserva che la somministrazione delle OMVs caricate di siRNA provoca comunque una crescita tumorale significativa, ma molto attenuata rispetto ai casi precedenti.
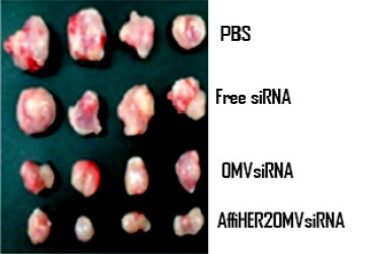
Però, il dato realmente interessante si ottiene in seguito alla somministrazione delle OMVs esprimenti l’affibody per HER2 e caricate di siRNA. Difatti, in questo caso l’incremento della massa tumorale appare enormemente rallentato. Inoltre, mentre il caso intermedio prevedeva l’utilizzo di OMVs non specifiche per HER2, e quindi che possono comportare anche effetti collaterali significativi, in quest’ultimo caso essendo le OMVs equipaggiate con l’affibody specifico e selettivo per HER2 delle cellule tumorali, nel tessuto sano non vi è nessun effetto collaterale. Quindi, concludendo, questa linea di ricerca è estremamente promettente per l’ottenimento di un’eventuale chemioterapia estremamente promettente.
Giovanna Spinosa
Fonti
- https://pubs.acs.org/doi/abs/10.1021/nn405724x;
- https://www.nature.com/articles/nrmicro3525;
- https://www.sciencedirect.com/science/article/pii/S001457931000284X.
Crediti delle immagini
- Figura 1: https://link.springer.com/article/10.1007/s41048-019-00095-6;
- Figura 2: https://it.wikipedia.org/wiki/Short_interfering_RNA.