Come si sono evoluti i magnetosomi nei batteri magnetotattici?
I batteri magnetotattici (MTB) rappresentano un affascinante gruppo polifiletico di batteri. Questi microrganismi vivono negli ambienti acquatici e sono distribuiti pressoché globalmente. All’interno dei corpi idrici prediligono zone a basso contenuto di ossigeno e si trovano spesso nell’interfaccia ossico-anossica della colonna d’acqua oppure nei sedimenti.
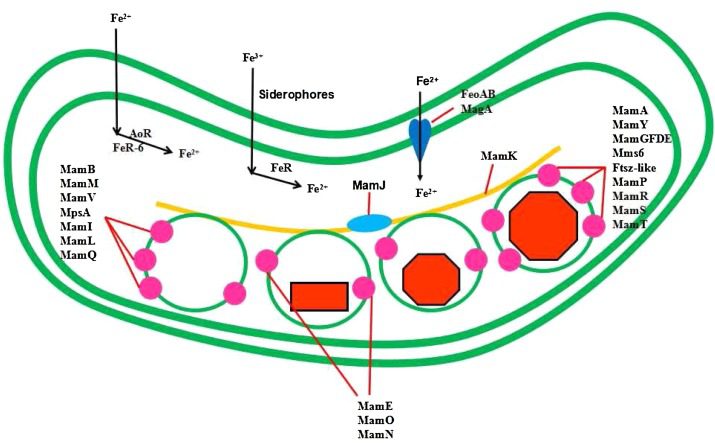
In questo articolo ripercorreremo le principali scoperte volte allo studio ed alla comprensione dei particolari organelli che rendono unici questi batteri: i magnetosomi (figura 1).

I batteri, secondo la definizione canonica, non hanno compartimenti subcellulari atti ad organizzare e facilitare le funzioni cellulari. Tuttavia, negli ultimi decenni, sono stati scoperti diversi organelli batterici, molti dei quali sono in grado di produrre biomateriali con funzioni specializzate.
Magnetosomi
I batteri magnetotattici sono caratterizzati dalla capacità di formare organelli chiamati magnetosomi, compartimenti lipidici all’interno dei quali si verifica la biomineralizzazione di cristalli magnetici di magnetite (Fe3O4) e / o grigite (Fe3S4). I magnetosomi si allineano in una o più catene lungo la cellula, creando un dipolo magnetico che consente agli MTB di allinearsi passivamente lungo le linee del campo magnetico terrestre.
Magneto-aerotassi
L’allineamento passivo lungo le linee del campo magnetico terrestre si pensa possa aiutare gli MTB a nuotare più efficientemente nella colonna d’acqua, poiché il loro movimento è limitato ad una sola dimensione. Questo affascinante processo prende il nome di magneto-aerotassi (figura 2).

Geni magnetosomici
Gli MTB codificano i geni necessari per questi processi nei cluster di geni magnetosomici (MGC).
Il sequestro di ferro dall’ambiente per la biomineralizzazione, la produzione di membrane fosfolipidiche di dimensioni specifiche e l’allineamento dei magnetosomi in lunghe catene sono processi complessi e strettamente controllati, in grado di fornire informazione sulla genesi degli organelli. Negli organismi modello più studiati —Magnetospirillum magneticum AMB-1, M. gryphiswaldense MSR-1 e Desulfovibrio magneticus RS-1 — gli MGC sono strutturati in isole geniche magnetosomiche (MAIs). Tra le specie correlate, vi è una grande quantità di omologia genetica nel MAI.
La genetica dei magnetospirilli
M. magnetotacticum MS-1 è stato il primo batterio magnetotattico ad essere isolato in coltura pura. Tuttavia, MS-1 non è diventato il sistema modello principale per le indagini genetiche poiché non sono state identificate condizioni capaci di supportare la crescita delle colonie su terreni solidi. Successivamente, i ceppi AMB-1 e MSR-1 sono stati coltivati con successo ed impiegati come organismi modello in laboratorio, rendendo possibile la manipolazione dei loro genomi.
I primi studi genetici
I primi studi genetici negli MTB hanno riguardato analisi di mutagenesi traspositiva accoppiate alla selezione magnetica ed alla microscopia elettronica a trasmissione (TEM).
Nel 1992, Matsunaga e collaboratori hanno eseguito la mutagenesi in AMB-1 con il trasposone Tn5. Dopo aver confermato che i mutanti erano carenti nella formazione di magnetosomi attraverso osservazioni di microscopia elettronica, hanno usato la mappatura delle restrizioni per restringere la posizione di ciascun sito di inserzione nel genoma.
Nei primi anni 2000 sono stati fatti notevoli passi avanti nella comprensione dei genomi degli MTB. Lo stesso team di ricerca ha infatti isolato i mutanti del trasposone Tn5 in AMB-1 e trovato colonie con difetti nella biomineralizzazione, osservando il colore di queste ultime; questo carattere infatti, si ritiene possa essere un indicatore della quantità di magnetite accumulata nella cellula.
La successiva pubblicazione delle sequenze del genoma di MS-1 e Magnetococcus marinus MC-1 ha aperto le porte agli studi a livello del genoma.
Geni
Attraverso numerosi studi, i ricercatori hanno concluso che il numero geni potenzialmente coinvolti nella formazione dei magnetosomi va da un minimo di 10 ad un massimo di 60 (figura 3).
Sempre nei primi anni del 2000, Gruberg e colleghi hanno confrontato le sequenze proteiche isolate dai magnetosomi MSR-1 con quelle dei genomi MS-1 e MC-1 ed hanno trovato due cluster di geni contenenti mamA, mamB, mamC e mamD, geni che ora sappiamo essere fondamentali per la formazione di magnetosomi.
MAI
La regione genomica chiave necessaria per la formazione del magnetosoma, il MAI, è stata scoperta quando i mutanti non magnetici spontanei dell’MSR-1 sono stati isolati da una popolazione naturale.
L’identificazione del MAI ha ristretto il pool di geni da investigare ed ha fornito le basi per studi genetici più mirati.
Funzione dei geni nel MAI
Questi studi sulle isole geniche di AMB-1 e MSR-1 hanno fornito un’ampia panoramica delle funzioni dei geni nel MAI. Inoltre, una terza categoria di geni coinvolti nell’organizzazione della catena è diventata un’importante area di studio negli ultimi anni.
La proteina MamK è necessaria per l’integrità e la corretta segregazione della catena durante la divisione cellulare.
MamJ funge da collegamento tra i filamenti di MamK e i magnetosomi.
MamY è una proteina di membrana citoplasmatica che lavora per allineare la catena del magnetosoma lungo l’asse di motilità della cellula. Di conseguenza, tale proteina potrebbe probabilmente migliorare l’efficienza della magnetotassi.
MamJ e MamY sono anche componenti chiave della formazione della catena.
Genetica e genomica di diversi MTB
Il lavoro sugli organismi modello MSR-1 e AMB-1 ha portato all’identificazione di molti dei geni fondamentali per la formazione e il posizionamento dei magnetosomi. Tuttavia, MSR-1 e AMB-1 sono entrambe specie appartenenti agli α-Proteobacteria. Successivamente, gli studi genetici in MSR-1 e AMB-1 sono stati impiegati come punto di partenza per il nuovo sistema modello D. magnetus RS-1, nonché per le specie non coltivate di MTB.
MAI in D. magneticus RS-1
L’istituzione del δ-Proteobacterium RS-1 come sistema modello ha aperto il campo allo studio della diversità genetica legata alla formazione di magnetosomi. Nella filogenesi degli proteobatteri, la classe dei δ-proteobatteri è profondamente ramificata, rispetto agli α-proteobatteri. Pertanto, la ricerca sui β-proteobatteri può fornire preziose informazioni sulle origini degli MTB. Attraverso lo studio di RS-1, è stato scoperto che, oltre ad un nucleo comune di geni richiesto in tutti gli MTB, diversi tipi di MTB hanno geni distinti per la formazione del magnetosoma. Presumibilmente i geni si sono evoluti per adattarsi ai diversi stili di vita di ciascun organismo.
Analisi comparative del Genoma
L’analisi comparativa del genoma di diversi δ-Proteobacteria ha rivelato che molti dei geni richiesti per la formazione del magnetosoma sono condivisi con gli α-Proteobacteria.
Altri studi hanno mostrato che MTB appartenenti a δ-Proteobacteria e Nitrospirae hanno una serie separata di geni specifici della classe chiamati mad. Questi geni sono probabilmente coinvolti nella produzione di cristalli di magnetite a forma di proiettile. I Nitrospirae invece, hanno mostrato un’altra serie di geni, i geni man, potenzialmente coinvolti nei processi di formazione del magnetosoma e / o disposizione a catena.
Storia evolutiva
Le analisi metagenomiche stanno inoltre contribuendo notevolmente alla nostra conoscenza della diversità dell’MTB e della loro storia evolutiva.
Nel 2011 Lefèvre ed i suoi colleghi hanno scoperto che il δ-Proteobatterio Desulfamplus magnetovallimortis BW-1 è in grado di produrre sia magnetite che grigite. È interessante notare che il genoma BW-1 ha geni mam in due MGC separati.
Le proteine codificate in un cluster sono strettamente correlate alle proteine trovate nelle specie che producono magnetite, mentre quelle nel secondo cluster sono più strettamente correlate alle proteine codificate nelle MGC dei produttori di grigite. L’ipotesi più semplice che emerge da queste intuizioni genomiche è che ciascun cluster è responsabile della produzione di un minerale magnetico chimicamente distinto.
Tuttavia, i geni mad, necessari per formare magnetosomi a forma di proiettile, sono presenti in entrambi i cluster. Non è ancora chiaro se questi geni siano stati persi durante l’evoluzione dei ceppi che producono magnetite che non formano cristalli a forma di proiettile o se siano stati acquisiti separatamente dai ceppi di δ-Proteobacteria e Nitrospirae di MTB.
Diverse analisi sugli α-Proteobatteri PR-1 hanno anche indicato che l’evoluzione dell’MTB ha probabilmente coinvolto sia l’ereditarietà verticale che il trasferimento genico orizzontale (HGT) o eventi di duplicazione.
Ulteriori analisi
Indagando ulteriormente le origini degli MTB, Lefèvre e colleghi hanno confrontato le filogenesi di diversi proteobatteri α-, δ- e γ e una specie di MTB afferente al phylum Nitrospirae.
Hanno quindi costruito alberi filogenetici usando sequenze di geni rRNA 16S; da questo confronto è emerso che entrambi gli alberi mostrano un modello simile di divergenza, portando alla conclusione che tutti i moderni Proteobatteri e Nitrospirae possano avere un antenato magnetotattico comune, sebbene non sia esclusa la possibilità di un antico evento HGT.
Studi successivi hanno inoltre analizzato i dati metagenomici per ottenere informazioni sulle origini degli MTB.
Gli autori hanno concluso, come Lefèvre e collaboratori, che l’HGT di geni magnetosomici siano stati probabilmente eventi rari. La conclusione più semplice basata su questi studi è che tutti gli MTB abbiano avuto origine da un antenato comune. In effetti, utilizzando orologi molecolari comunemente accettati, si può stimare che l’MTB originale – e presumibilmente il primo caso di formazione di magnetosomi – sia apparso circa 3,2 miliardi di anni fa.
Applicazioni biotecnologiche
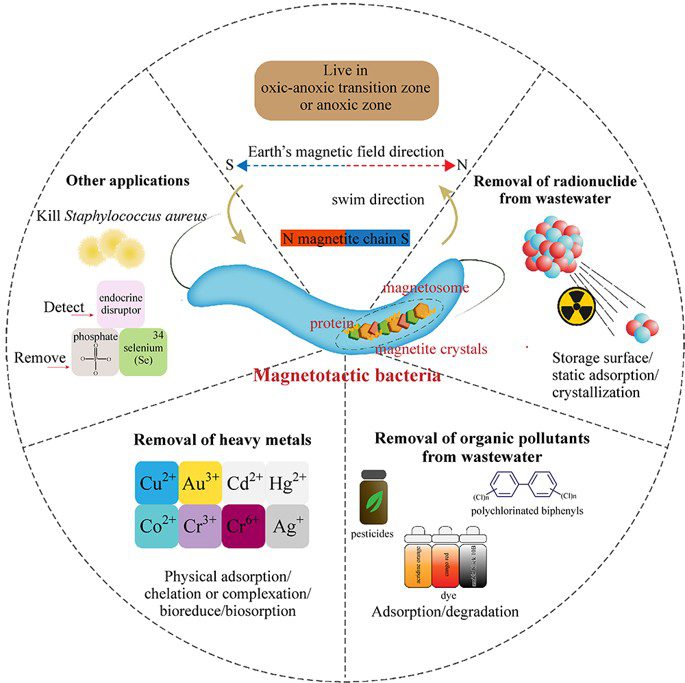
L’uso degli MTB in varie applicazioni biotecnologiche risulta estremamente promettente. I magnetosomi sono attualmente in fase di studio per il loro impiego come agenti di contrasto di risonanza magnetica (MRI), sistemi di somministrazione di farmaci, trattamenti ipertermici e fototermici per il cancro, biorisanamento di metalli pesanti e altre nanotecnologie (figura 4) .
Al fine di produrre in modo efficiente il gran numero di magnetosomi richiesti in queste applicazioni, è fondamentale capire in maniera chiara i meccanismi di formazione dei magnetosomi.
Importanza ecologica
Oltre alle possibili applicazioni, anche l’impatto ecologico degli MTB rappresenta un’area di ricerca in espansione. Nel processo di biomineralizzazione della magnetite o della grigite, gli MTB raccolgono grandi quantità di ferro disciolto dall’ambiente circostante e lo sequestrano nei magnetosomi come cristalli di ferro. Pertanto, il ruolo che gli MTB svolgono nel ciclo del ferro sia nei corpi d’acqua dolce che nell’oceano risulta estremamente importante.
Stime prudenti indicano che gli MTB degli estuari e quelli oceanici possono assorbire ovunque dall’1% al 50% circa degli input di ferro disciolto (circa 9 × 108 kg all’anno) in tali ambienti. Una maggiore comprensione delle strategie di regolazione del ferro codificate all’interno dei genomi degli MTB, nonché del modo in cui questo metallo viene assorbito e distribuito nei magnetosomi, potrebbe quindi fornire un quadro più accurato del ruolo degli MTB all’interno degli ambienti acquatici.
Conclusioni
Sono stati fatti enormi passi avanti nella comprensione della genetica alla base della formazione dei magnetosomi. Tuttavia, molteplici aspetti legati a tali fenomeni devono ancora essere pienamente compresi. Ulteriori informazioni riguardo l’origine dei magnetosomi e le funzioni di molti geni connessi alla loro produzione potrebbero arricchire l’ampio spettro di applicazioni biologiche e biotecnologiche connesse agli MTB.
Riferimenti bibliografici
- Mathuriya, Abhilasha Singh, Kratika Yadav, and B. D. Kaushik. “Magnetotactic Bacteria: Performances and Challenges.” Geomicrobiology Journal 32.9 (2015): 780-788.
- Lin, Wei, et al. “Genomic expansion of magnetotactic bacteria reveals an early common origin of magnetotaxis with lineage-specific evolution.” The ISME journal 12.6 (2018): 1508-1519.
- McCausland, Hayley C., and Arash Komeili. “Magnetic genes: Studying the genetics of biomineralization in magnetotactic bacteria.” PLoS Genetics 16.2 (2020): e1008499.
- Uebe, René, and Dirk Schüler. “Magnetosome biogenesis in magnetotactic bacteria.” Nature Reviews Microbiology 14.10 (2016): 621.
- Wang, Xu, et al. “Novel protein Mg2046 regulates magnetosome synthesis in Magnetospirillum gryphiswaldense MSR-1 by modulating a proper redox status.” Frontiers in microbiology 10 (2019): 1478.
- Wang, Yinzhao, et al. “Genomic evidence of the illumination response mechanism and evolutionary history of magnetotactic bacteria within the Rhodospirillaceae family.” BMC genomics 20.1 (2019): 1-13.