Sembra che, se il batterio S. aureus venga infettato da un virus, un enzima virale aiuti il microbo ad eludere il sistema immunitario.

Le superfici del nostro corpo sono ricoperte da diverse specie di microrganismi. E queste specie non sono frutto di un assemblaggio casuale; piuttosto, sono una comunità di organismi ben adattati alle condizioni locali di temperatura, umidità, disponibilità di nutrienti e difese dell’ospite. Lo Staphylococcus aureus è uno dei nostri residenti batterici più comuni e ha la capacità di provocare un’infezione potenzialmente mortale.
Negli ultimi 50 anni, la resistenza di S. aureus agli antibiotici è diventato un problema crescente relativamente adi ceppi del batterio denominati MRSA, ovvero quei ceppi resistenti al trattamento con la meticillina antibiotica che causano infezioni in ospedale e in comunità in tutto il mondo. Gerlach et al. descrivono un meccanismo precedentemente sconosciuto per cui i virus influenzano il riconoscimento di MRSA dal sistema immunitario.
Lo stafilococco aureo sembra avere la capacità di riscontrare i segni di debolezza dell’ospite, come la riduzione delle difese immunitarie causate dalla malattia. Quando viene rilevato, il batterio può aumentare la sua popolazione ad un livello che può causare la morte dell’ospite. I fattori che regolano le interazioni ospite-microbo sono complessi e, oltre alle difese dell’ospite, tali interazioni possono essere influenzate dalla presenza o dall’assenza di altri batteri. Gerlach e colleghi riferiscono che anche i virus possono essere parte del mix che influenza le interazioni ospite-microbo nel contesto di MRSA.
Nei batteri Gram-positivi come S. aureus, la parete cellulare contiene polimeri noti come acidi teicoici a parete (WTA), costituiti da molecole di ribitolo fosfato o glicerolo fosfato. A differenza dell’altro componente principale della parete cellulare, il peptidoglicano, che forma un reticolo poroso e relativamente insolubile, il WTA forma un materiale altamente idratato simile a gel che riempie gran parte dello spazio tra i fili del peptido-glicano.
In S. aureus, Il WTA è composto da unità di d-ribitol fosfato che sono reticolate al peptidoglicano (Figura 1).
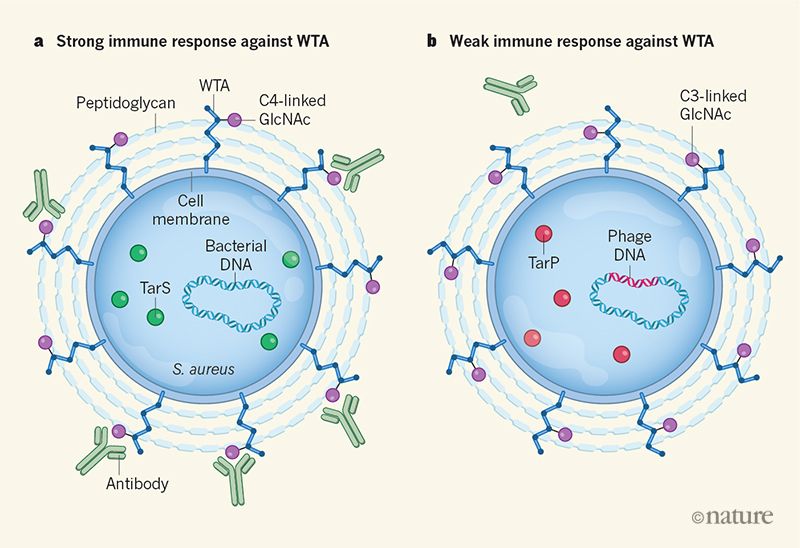
Figura 1 | L’infezione virale di un batterio può alterare la risposta immunitaria dell’ospite al microbo. a La superficie esterna di S. aureus è rivestita con strati di peptidoglicano reticolati a parete acidi teicoici (WTA) – polimeri di molecole di ribitolo fosfato. L’enzima batterico TarS modifica il WTA, generando una forma che ha la molecola GlcNAc attaccata agli atomi di carbonio nella posizione C4 nel ribitolo. Gli anticorpi umani contro S. aureus spesso prendono di mira il WTA. b Gerlach et al. riportano alcuni ceppi di S. aureus resistenti agli antibiotici che sono associati a infezioni difficili da trattare e che sono stati infettati da un virus chiamato fago. Il DNA fagico codifica un enzima chiamato TarP che lega GlcNAc a WTA ad atomi di carbonio nella posizione C3 di ribitolo piuttosto che nella normale posizione C4. Negli studi su topi e cellule umane, gli autori scoprono che questi WTA modificati con TarP innescano una risposta immunitaria più debole rispetto alla risposta al WTA con TarS.
Gli autori hanno studiato le sequenze del genoma dei ceppi di MRSA per identificare i geni che codificano gli enzimi che modificano il WTA. Questo ha rivelato che alcuni ceppi di MRSA codificano un enzima chiamato TarP che catalizza l’aggiunta di GlcNAc al d-ribitol fosfato in un particolare atomo di carbonio (noto come C3) nel ribitolo.
Sorprendentemente, la sequenza di codifica di TarP è diorigine virale e si trova in S. aureus a causa dell’infezione da un virus batterico chiamato fago. TarP è dominante sulla sua controparte batterica, TarS – cioè, se entrambi gli enzimi sono presenti, il legame GlcNAc è fatto sul carbonio C3 di ribitolo, piuttosto che sul carbonio C4.
Lo S. aureus viene normalmente tenuto sotto controllo perché il sistema immunitario ha la capacità di rilevarlo. Tuttavia, gli autori hanno scoperto che, nei topi, la forma di WTA creata dall’azione di TarP ha meno probabilità di innescare una risposta immunitaria rispetto alla forma di WTA generata da TarS.
Siamo ora agli albori di un’era clinica in cui l’obiettivo sarà quello di gestire con precisione le interazioni umane e microbiche per promuovere la salute e limitare le malattie.
Gli antibiotici continueranno ad avere un ruolo chiave?
Sì, ma capire come determinare l’approccio migliore sarà aiutato dallo sviluppo di nuovi strumenti diagnostici e da una comprensione più chiara della natura delle interazioni umane e microbiche. Se si decide di adottare un approccio basato su un vaccino o possibilmente utilizzando trattamenti per fagi in futuro, le considerazioni chiave comprenderanno come varia la suscettibilità di un batterio all’infezione del fago.
Il lavoro di Gerlach e colleghi, così come quello di altri in quest’area, dimostra che l’equilibrio tra ospite e microbi è dinamico. La scoperta che i fagi possono avere un ruolo nel ribaltare il delicato equilibrio tra colonizzazione di S. aureus e infezione potrebbe un giorno influenzare la scelta degli approcci per il trattamento delle infezioni da MRSA.
Salvatore Gemmellaro
Fonte: Nature, International Journal of Science
Ulteriori letture: