CARATTERISTICHE
Salmonella typhi appartiene all’ampio gruppo delle Enterobacteriaceae. Le Enterobacteriaceae rappresentano il più cospicuo ed eterogeneo gruppo di batteri gram-negativi di interesse medico. Alcune specie sono patogene (Salmonella typhi, Shigella spp., Yersinia pestis), mentre altre fanno parte della normale flora commensale e possono causare occasionalmente infezioni opportunistiche (Escherichia coli, Klebsiella pneumonie, Proteus mirabilis).
La cellula batterica di Salmonella possiede numerosi antigeni e tra questi quelli più conosciuti sono:
- Gli antigeni somatici (O), termostabili e resistenti all’azione di acidi e alcool;
- Gli antigeni ciliari (H), termolabili;
- L’antigene Vi (da virulenza).
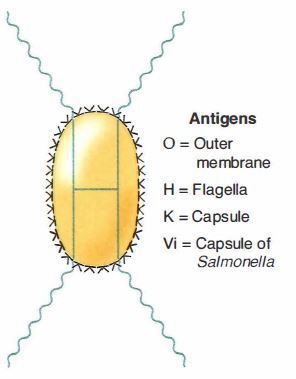
Figura 1 – Antigeni più caratteristici di Salmonella
Salmonella typhi, inoltre, come tutte le Enterobacteriaceae presenta le seguenti caratteristiche:
- È gram-negativo;
- È anaerobio facoltativo;
- Fermenta il glucosio;
- Riduce il nitrato;
- È catalasi-positivo;
- È ossidasi-negativo;
- La membrana esterna li rende sensibili all’essiccamento;
- Il lipopolisaccaride (LPS) è formato dal polisaccaride O somatico esterno, core polisaccaridico (antigene comune), lipide A (endotossina);
- Più di 2400 sierotipi O.
FILOGENESI
| Dominio | Prokaryota |
|---|---|
| Regno | Bacteria |
| Phylum | Proteobacteria |
| Classe | Gammaproteobacteria |
| Ordine | Enterobacteriales |
| Famiglia | Enterobacteriaceae |
| Genere | Salmonella |
| Specie | Salmonella enterica |
| Sottospecie | S. enterica subsp. enterica |
| Sierotipo | Typhi |
MORFOLOGIA DELLE COLONIE
Le salmonelle crescono facilmente su terreni sia liquidi che solidi.
Terreni liquidi:
- Trypticase Soy Broth (TSB);
- Brodo Brain Heart Infusion (BHI);
- Brodo selenito;
- Brodo tetrationato.
Terreni solidi non selettivi:
- Dopo incubazione a 37 °C per 24 ore, le colonie appaiono tonde, del diametro di 2-3 mm, a margine netto, convesse, incolori, generalmente a superficie liscia, lucente (fase S) e raramente a superficie opaca e ruvida (fase R);
- Su Agar sangue le colonie raggiungono dimensioni leggermente maggiori rispetto ai comuni terreni solidi e non presentano emolisi. In alcuni casi si osservano colonie “nane” , ad esempio per S. choleraesuis, S. abortusequi, S. abortusovis, S. gallinarum, S. pullorum.
Terreni solidi selettivi e/o differenziali:
- Le colonie si presentano con diametro inferiore e colorazioni diverse. In provette di Kligler Iron Agar, seminate per striscio e successiva infissione, le salmonelle crescono in genere abbondantemente, mostrando uno “slant” alcalino (rosso) e un fondo acido (giallo), accompagnato spesso da bolle di gas originato dalla fermentazione del glucosio.
Inoltre, i terreni di coltura comunemente usati per l’isolamento di Salmonella da un campione clinico e le loro caratteristiche della colonia sono i seguenti:
- Bismuth sulfite agar: le colonie appaiono nere;
- Agar sangue: le colonie appaiono bianche, lisce e non emolitiche;
- MacConkey Agar: le colonie appaiono pallide, lisce, lattosio non fermentati;
- Deoxycholate Citrate Agar (DCA): le colonie appaiono pallide;
- Agar Xylose Lysin Deoxycholate (XLD): le colonie appaiono rosa,lattosio non fermentanti, e nere al centro a causa della produzione di H2S;
- Wilson Blair Media: S. typhi forma grandi colonie nere con una lucentezza metallica.

Figura 2 – Tipica morfologia di Salmonella su Agar Xylose Lysine Deoxycholate (XLD)
PATOGENESI
Salmonella entra nel tubo digerente per ingestione, passa lo stomaco e giunge nel tenue, dove si lega alle cellule M delle placche di Peyer, le invade e si replica all’interno.
Salmonella usa due sistemi separati di secrezione di tipo III per penetrare nelle cellule M:
- Legame: mediato da fimbrie specie-specifiche;
- Sistema di secrezione SPI-1: introduce le proteine di invasione secreta da Salmonella (Sips o Ssps) nelle cellule M → modificazione dell’actina → increspamento della membrana;
- Le membrane circondano e inglobano Salmonella, questa si replica nella cellula ospite, nel fagosoma. Segue la morte della cellula ospite e la diffusione dei batteri alle cellule epiteliali e linfoidi adiacenti.
La Salmonella si ritrova in quasi tutti gli animali:
- Pollame;
- Rettili;
- Bestiame;
- Roditori;
- Animali domestici;
- Uccelli;
- Uomo.
Il contagio animale-animale e l’utilizzo di mangimi contaminati da Salmonella permettono il mantenimento di un serbatoio animale. Alcuni sierotipi, come S. typhi e S. paratyphi sono fortemente adatti all’uomo e non causano malattie in altri ospiti.
L’infezione da S. typhi si verifica quando sono ingeriti cibo e acqua contaminati da persone infette. Si trasmette da persona a persona e resta asintomatico dopo l’infezione a lungo termine.
Salmonella typhi provoca una malattia febbrile detta febbre tifoide.
I batteri responsabili della febbre enterica passano attraverso le cellule che rivestono l’intestino e vengono fagocitati dai macrofagi.
Si moltiplicano dopo essere stati trasportati al fegato, alla milza e al midollo osseo. 10-14 giorni dopo l’infezione aumenta la temperatura corporea, assieme a sintomi non specifici, come:
- Cefalea;
- Mialgie;
- Malessere;
- Anoressia.
Tali sintomi permangono per una settimana o più, seguiti da sintomi
gastroenterici. Tale ciclo corrisponde ad una fase iniziale di batteriemia. Successivamente si ha la colonizzazione della cistifellea e la reinfezione dell’intestino.
METODI DI IDENTIFICAZIONE
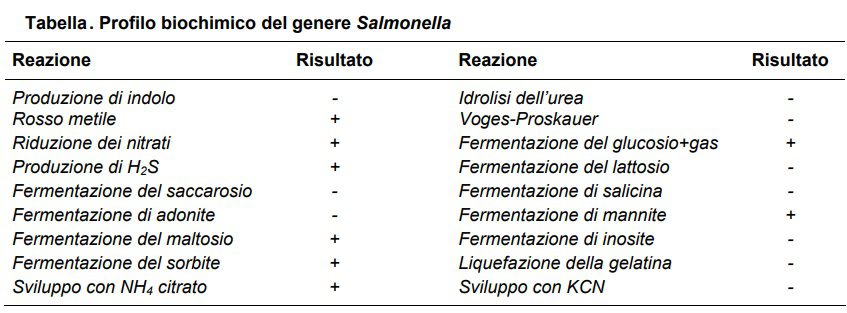
Il profilo biochimico del genere Salmonella è il seguente:
Salmonella può essere isolata tramite:
- Isolamento da campioni di origine umana;
- Isolamento da campioni di origine animale;
- Isolamento da alimenti;
- Isolamento da campioni ambientali.
Per la diagnosi di Salmonella si possono eseguire ulteriori test, come:
- Test di agglutinazione al lattice;
- Agglutinazione su vetrino con antisieri;
- MUCAP Test;
- Ossidasi;
- Test dell’indolo;
- Test del’urea;
- Test della catalasi;
- Test del Triple Sugar Iron Agar – TSI Test;
- Test dell’arginina deidrolasi;
- Test della lisina decarbossilasi;
- Test dell’ ornitina decarbossilasi;
- Test Voges Proskauer (VP) ;
- Test del rosso metile;
- Test dell’acido citrico.
TERAPIA
Per le infezioni da S. typhi bisona selezionare l’antibiotico efficace attraverso test di sensibilità.
Si possono usare:
- Fluorochinoloni (ciprofloxacina);
- Cloramfenicolo;
- Trimetoprima;
- Cefalosporine ad ampio spettro.
La maggior parte delle infezioni può essere controllata attraverso un’adeguata cottura di pollame e uova, evitando di contaminare altri alimenti non cotti.
Fonti:
- Corso di batteriologia – www.bluejayway.it
- Principi di microbiologia medica di G. Antonelli, M. Clementi, G. Pozzi (a cura di), 2017.
- Principi di microbiologia medica di Michele La Placa.
- Microbeonline
- Infezioni da Salmonella: diagnostica, epidemiologia e sorveglianza di Caterina Graziani, Pasquale Galetta, Luca Busani, Anna Maria Dionisi, Emma Filetici, Antonia Ricci, Alfredo Caprioli, Ida Luzzi.
Fonti immagini:
1 commento su “Salmonella typhi”