Caratteristiche
Thermus aquaticus è un batterio Gram-negativo, termofilo estremo, ovvero in grado di sopravvivere a temperature elevate, oltre i 70°C.
E’ stato isolato per la prima volta negli anni Sessanta da una sorgente termale (Figura 1) nel Parco Nazionale di Yellowstone negli Stati Uniti dal ricercatore T. Brock. Pochi anni dopo, da T. aquaticus è stato isolato l’enzima più comunemente utilizzato nell’ambito delle biotecnologie moderne: la Taq polimerasi utilizzata per l’esecuzione della PCR (polymerase chain reaction).

La Taq polimerasi per la PCR
Il motivo per cui la Taq polimerasi, ovvero la polimerasi estratta da T. aquaticus utilizzata nella PCR, viene preferita ad altre polimerasi risiede nella resistenza ai numerosi cicli ad elevate temperature che caratterizza appunto la tecnica in questione.
La reazione della PCR, messa a punto da Kary Mullis nel 1983, consiste nel susseguirsi di 35-40 cicli di amplificazione di una determinata sequenza di DNA: ciascun ciclo (Figura 2) è caratterizzato da 3 fasi (denaturazione, annealing, allungamento) che avvengono a temperature diverse (rispettivamente a 95°C, 40-55°C, 65-72°C).

La Taq polimerasi di T. aquaticus è in grado di resistere a tali variazioni di temperatura e a mantenere un elevato grado di efficienza nel corso della procedura. La resistenza alle elevate temperature è dovuta all’adattamento dell’enzima all’ambiente naturale in cui vive T. aquaticus.
La Taq polimerasi, inoltre, viene preferita agli altri enzimi in quanto ha un’elevata accuratezza, compresa tra 1×10-4 e 2×10-5 errori per paia di basi. Inoltre, non è necessario che sia del tutto pura in soluzione per poter essere utilizzata. Queste caratteristiche, nel complesso, fanno sì che la Taq polimerasi possa essere efficacemente utilizzata sia per la PCR che per tutte quelle tecnologie basate sulla PCR (produzione di enzimi, DNA fingerprinting, diagnosi genetiche/mediche).
Ecologia
Essendo un batterio termofilo, T. aquaticus vive in ambienti estremi, caratterizzati da elevatissime temperature, pH leggermente basico e bassa salinità. La temperatura ottimale di crescita è superiore ai 70 °C.
E’ stato inizialmente isolato da una sorgente termale nel Parco nazionale di Yellowstone, come già anticipato, ma la sua presenza è stata riscontrata anche in sorgenti termali marine, solfatare a bassa salinità.
Filogenesi
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Deinococcus-Thermus |
| Classe | Deinococci |
| Ordine | Thermales |
| Genere | Thermus |
| Specie | aquaticus |
Morfologia delle colonie
Le cellule di T. aquaticus possono avere forma bastoncellare (Figura 3) o filamentosa corta: le cellule a forma di bastoncelli in genere tendono ad allinearsi tra loro o in alternativa ad aggregarsi per formare dei corpi sferici del diametro variabile tra 10 e 20 μm.
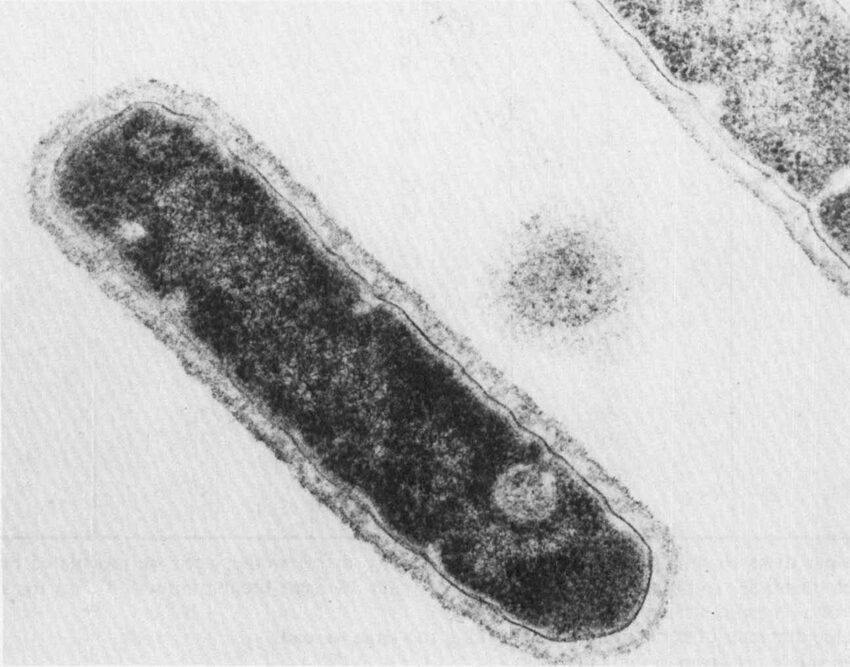
Nello specifico, questi corpi sono ricoperte da uno strato di peptidoglicano modificato (Figura 4), che sembra essere coinvolto nell’adesione tra colonie e nell’inclusione di fonti nutritive.
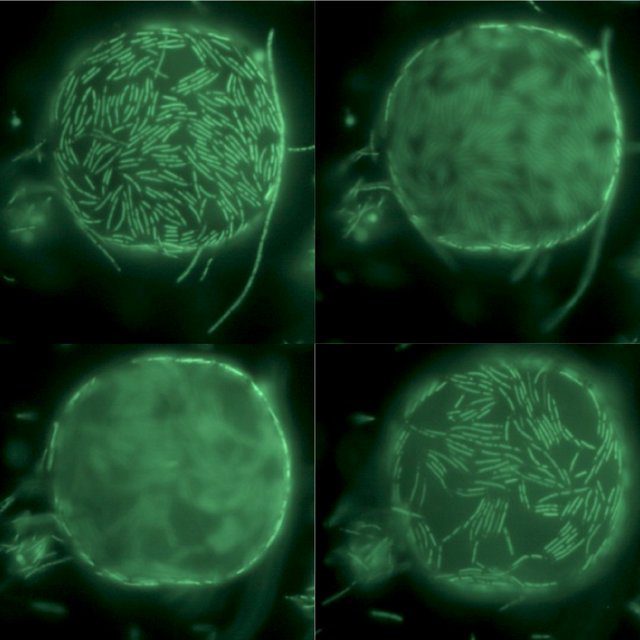
Quando esposto alla luce del sole diretta, T. aquaticus può assumere una colorazione che varia dal giallo, al rosa o all’azzurro chiaro in seguito all’accumulo di particolari pigmenti all’interno delle cellule.
Anche le colonie di T. aquaticus possono assumere morfologie diverse a seconda delle condizioni di crescita. In genere, si comportano come le altre specie appartenenti al genere Thermus: formano delle colonie di piccolo diametro con bordi regolari e dal colore variabile a seconda dell’accumulo di pigmenti, come già detto.
Patogenesi
T. aquaticus non è stato identificato come possibile patogeno né per l’uomo né per gli animali, date le condizioni ambientali in cui vive (elevata temperatura e salinità) incompatibili con la vita umana e animale.
Metodi di identificazione
Per l’identificazione di T. aquaticus si utilizzano principalmente le tecniche di identificazione molecolare basate sull’amplificazione tramite PCR di specifici tratti di DNA e relativo sequenziamento. Solitamente le sequenze utilizzate a tale scopo sono:
- sequenze specifiche del DNA ribosomale 16S;
- il gene 5S della subunità maggiore del ribosoma.
Oltre al sequenziamento e successivo allineamento in banca dati, è possibile analizzare le sequenze amplificate mediante la tecnica rDNA PCR RFLP (restriction fragment length polymorphism). Essa consiste nell’amplificare regioni specifiche del DNA, come quelle menzionate in precedenza, e sottoporle a trattamento con enzimi di restrizione. Una corsa elettroforetica permetterà poi di individuare le dimensioni dei frammenti, che sono specie-specifiche, e consentono quindi di identificare le specie di interesse come T. aquaticus in questo caso.
Per la coltivazione in laboratorio si utilizza un terreno denominato YTP-2, a base di triptone e succo di pomodoro chiarificato, e condizioni di crescita estreme: 70 °C e anaerobiosi o aerobiosi controllata.
Fonti
- Brock, Thomas D. and Mercedes R. Edwards (1970) “Fine Structure of Thermus aquaticus, an Extreme Thermophile.” Journal of Bacteriology, Oct 1970, Vol 104. p 509-517.
- Brumm PJ, Monsma S, Keough B,Jasinovica S, Ferguson E, Schoenfeld T, et al. (2015) Complete Genome Sequence of Thermus aquaticusY51MC23. PLoS ONE 10(10): e0138674.doi:10.1371/journal.pone.0138674