La catalasi è un enzima perossisomiale presente nella maggior parte degli organismi viventi e svolge un ruolo chiave nella neutralizzazione del perossido di idrogeno. La catalasi, insieme ad altre molecole antiossidanti, esercita un’azione “protettiva” dai radicali liberi. Questi ultimi, sono molecole costituite da uno o più elettroni spaiati nel loro orbitale atomico o molecolare. Pertanto, essendo instabili e di breve durata, sono chimicamente reattive e possono ossidare o provocare qualsiasi modificazione chimica su ogni molecola biologica.
In particolar modo, le specie reattive dell’ossigeno (ROS) sono onnipresenti e sono generate come sottoprodotti delle attività enzimatiche e del metabolismo aerobico. Ad esempio, possono formarsi fisiologicamente durante il processo di respirazione cellulare e, in particolare, lungo la catena di trasporto degli elettroni mitocondriali. Lo squilibrio tra produzione e distruzione dei ROS provoca il cosiddetto stress ossidativo, il quale, è implicato in molti disturbi degenerativi metabolici e neurologici. In particolare, differenti studi hanno constatato che stress ossidativo, invecchiamento e malattie degenerative sono interconnessi.
Tuttavia, come già accennato, il nostro organismo presenta un meccanismo di difesa contro lo stress ossidativo a cui partecipano sia molecole enzimatiche che non. Il sistema di difesa antiossidante è costituito da alcuni enzimi, alcune proteine e alcune molecole a basso peso molecolare. Gli enzimi antiossidanti possono rimuovere cataliticamente le specie reattive. In particolare, la catalasi è prodotta dalle cellule insieme alla superossido dismutasi (SOD) ed esplicano, in sinergia, la loro azione antiossidante.
Struttura molecolare della catalasi
La catalasi è un enzima appartenente alla famiglia delle ossidoreduttasi ed è un tetramero di 4 catene polipeptidiche di lunghezza minima di 500 amminoacidi. All’interno del tetramero vi sono 4 gruppi ferrosi che permettono all’enzima di reagire con il perossido d’idrogeno (Fig.1). La struttura delle catalasi è molto stabile, poco propensa al folding, resistente in un ampio range di pH e alla denaturazione termica.

Storia della Catalasi
La catalasi è stata una delle prime proteine ad essere cristallizzata negli studi condotti da Sumner e Dounce nel 1937. Da allora, sono state risolte 14 strutture 3D. La scoperta delle strutture cristalline è stata fondamentale per lo studio del meccanismo di degradazione del perossido di idrogeno. In particolare, l’architettura dei canali del substrato che conducono al sito attivo, giocano un ruolo cruciale nella catalisi enzimatica. Il canale di accesso principale, altamente selettivo, situato perpendicolarmente al piano dell’eme, è stato identificato come la via preferenziale di accesso dell’H₂O₂ al sito attivo della catalasi dei mammiferi.
Meccanismo d’azione
Sebbene il perossido di idrogeno, a bassi livelli, funga da molecola di segnalazione, risulta altamente tossico alle più alte concentrazioni. Infatti, tale molecola può essere convertita in specie reattive più tossiche dell’ossigeno che, a loro volta, possono poi danneggiare altre molecole e il DNA cellulare.
Meccanismo d’azione in presenza di alti livelli di H₂O₂
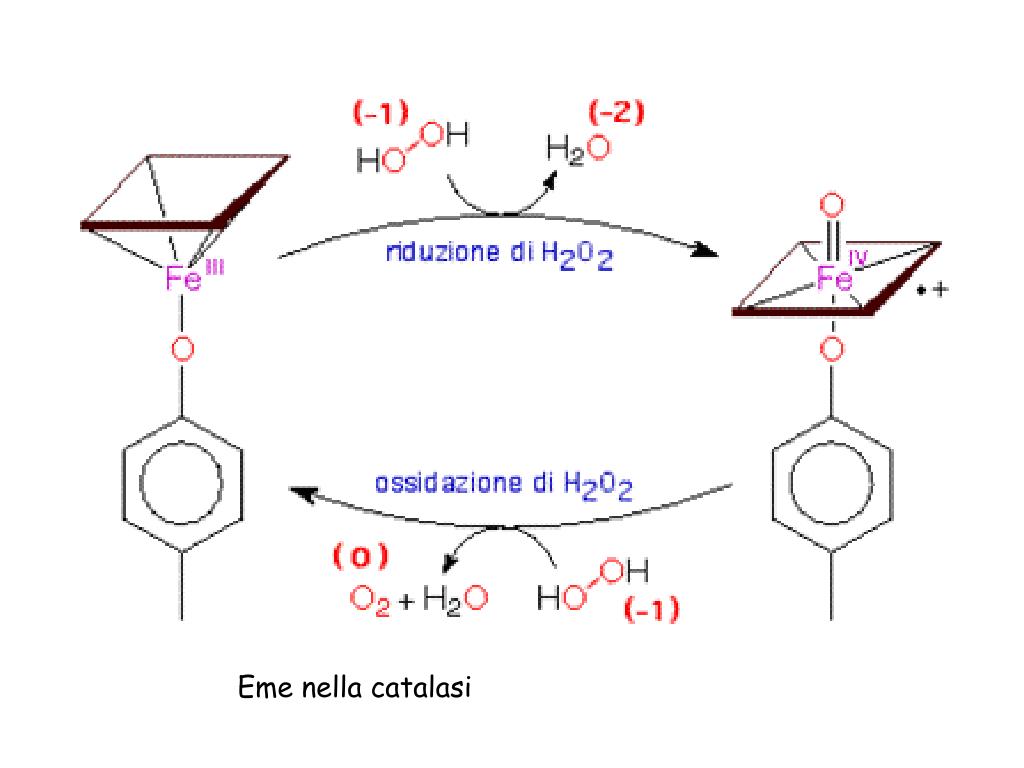
La catalasi, presente in quasi tutti gli organismi aerobici, svolge quindi la sua azione antiossidante. In particolare, in presenza di alte concentrazioni di perossido d’idrogeno, scompone due molecole di H₂O₂ in due fasi:
- Nella prima fase: l’enzima lega una molecola di H₂O₂ spezzandola in due frammenti. Il primo, è un atomo di ossigeno, il quale rimane legato al ferro dell’eme; il secondo frammento è rilasciato come semplice acqua;
- Nella seconda fase: l’enzima lega una seconda molecola di perossido d’idrogeno. Anche in questo caso, la molecola si spezza in due frammenti diversi. L’ossigeno si combina con l’altro atomo di ossigeno già legato al ferro producendo ossigeno gassoso mentre il secondo frammento è rilasciato sottoforma di acqua (Fig. 2).
Meccanismo d’azione in presenza di bassi livelli di H₂O₂
In condizioni di basse concentrazioni di H₂O₂, si verifica un percorso alternativo. La natura ossidante del gruppo ossiferrilico, formatosi nella prima fase, consente ai radicali idrossili di uscire dal canale del substrato verso il sito attivo. I radicali possono così ossidare le molecole di etanolo in molecole di acetaldeide al di fuori del sito attivo.

Inibizione della catalasi
Un qualunque ione di metallo pesante agisce come un inibitore non competitivo sulla catalasi. Anche i veleni cianidi sono inibitori competitivi della catalasi poiché possono legarsi stabilmente al sito attivo della catalasi e bloccare l’azione dell’enzima.
Carenza o malfunzionamento
La carenza o il malfunzionamento della catalasi è associata a molte malattie come il diabete mellito (poiché il perossido di idrogeno libero danneggia le cellule beta del pancreas alterando la secrezione dell’insulina), la vitiligine, le malattie cardiovascolari, la malattia di Wilson, l’ipertensione, l’anemia, alcuni disturbi dermatologici, il morbo di Alzheimer, il disturbo da bipolarismo e la schizofrenia. In particolare, poiché tale antiossidante protegge le cellule dall’assalto ossidativo, diversi studi hanno osservato che basse attività dell’enzima sono associate a pazienti schizofrenici e a pazienti con aterosclerosi.
È stato, inoltre, osservato che un’anomalia dell’attività della catalasi è ereditata nell’acatalasemia: una malattia genetica rara causata da delle mutazioni nel gene che codifica per la catalisi. È una malattia a carattere autosomico recessivo caratterizzata da bassi livelli dell’enzima della catalasi nel sangue e nei tessuti. Il sangue dei soggetti omozigoti, a contatto con perossido d’idrogeno, assume una colorazione nerastra e non forma le consuete bolle.
La catalasi in microbiologia
Come già ribadito, la catalasi è un enzima “protettivo” utilizzato dalla maggior parte degli organismi viventi, compresi i batteri, per difendersi dal perossido d’idrogeno, il quale, è fortemente reattivo nei confronti delle membrane cellulari e degli acidi nucleici.
Tuttavia, non tutti i ceppi batterici sono in grado di produrre tale enzima. A tal proposito, un metodo molto utilizzato per l’identificazione microbiologica è rappresentato dal test della catalasi. Per l’esecuzione del test, una colonia batterica è posta su un vetrino e, mediante un’ansa da inoculo, viene stemperata una goccia di perossido d’idrogeno. Dopo qualche secondo, si osserva il risultato: la positività al test è associata alla produzione di bolle di ossigeno visibili sul vetrino.
Fonti
- Role of Catalase in Oxidative Stress- and Age-Associated Degenerative Diseases – PMC (nih.gov)
- Mechanisms of oxidant generation by catalase – PMC (nih.gov)
Fonti Immagini
- Immagine in evidenza e Figura 1: https://it.erch2014.com/images/obrazovanie/ferment-katalaza-osnovnie-osobennosti.jpg
- Figura 2: slide6-l.jpg (1024×768) (slideserve.com)
- Figura 3: Catalasi – Metabolismo dell’alcol | Association LEA (assolea.org)