In natura, generalmente, gli atomi non sono mai presenti come unità singolari, ma sono sempre associati tra loro a formare molecole. Gli unici a fare eccezione sono gli elementi dell’ultimo gruppo della tavola periodica: i gas nobili. Per questo loro comportamento di non reagire con altri elementi a formare molecole sono anche definiti gas inerti. Per cui, questi elementi non instaurano alcun tipo di interazione al fine di formare legami con altri atomi. Pertanto, anche gli elementi che esistono in natura al loro stato puro, in realtà si presentano sotto forma di molecole. Per esempio, l’ossigeno in atmosfera è presente in forma di molecola biatomica O2.
Volendo dare una definizione, un legame chimico altro non è che una forza attrattiva che tiene uniti due (o più) atomi, indipendentemente se uguali o diversi tra di loro, a formare una molecola o composto cristallino.
Energia di legame
Ciascun atomo tende a formare legami con altri atomi al fine di raggiungere lo stato energetico più basso, che rappresenta la condizione di massima stabilità. L’energia potenziale di una molecola, infatti, risulta essere inferiore rispetto a quella dei singoli atomi che la compongono. La molecola risultante avrà quindi una maggiore stabilità, dal momento che parte dell’energia iniziale viene ceduta verso l’ambiente esterno.
La formazione dei legami segue perfettamente la regola dell’ottetto secondo cui un atomo avente il livello elettronico esterno (guscio di valenza) completo si trova nella condizione di massima stabilità energetica e tende a non formare ulteriori legami. Come già accennato, i gas nobili fanno eccezione poiché possiedono già la configurazione di massima stabilità con 2 elettroni nel guscio più esterno per l’elio e 8 per tutti gli altri. Pertanto, gli atomi cercano di raggiungere la configurazione di stabilità dei gas nobili che li precede o segue lungo la tavola periodica, arrivando così ad avere gli 8 elettroni nel guscio più esterno.
Questo concetto è ben approfondito dal potenziale di Morse, che prende il nome dal fisico statunitense Philip McCord Morse che per primo elaborò il modello per la comprensione della formazione di un legame chimico sulla base dell’energia potenziale (Figura 1).

Come si può apprezzare dal grafico in figura, due atomi posti ad una distanza “r” tra di loro possiedono un’energia potenziale pari a zero. Man mano che questi si avvicinano tra loro, quindi a valori più bassi di “r” (spostandoci quindi verso sinistra) entrano in gioco due forze:
- forze attrattive che favoriscono l’avvicinamento dei due atomi, che si instaurano tra i nuclei di ciascun atomo (carica positiva determinata dai protoni) e le nuvole elettroniche (carica negativa degli elettroni) dell’altro;
- forze repulsive che allontanano e sfavoriscono la formazione del legame, instauratosi tra le cariche uguali dei due nuclei e delle due nuvole elettroniche.
Diagramma di Morse
All’avvicinarsi dei due atomi, dunque, ciascun elettrone è attratto dal nucleo dell’altro atomo e, contestualmente, gli elettroni si respingono tra loro così come i due nuclei. In seguito all’avvicinamento, l’energia potenziale del sistema comincia a diminuire (cioè diventa più negativo). Ciò è dovuto ad un nuovo ri-arrangiamento della nuvola elettronica così da controbilanciare le forze repulsive. Questo fino a quando non si raggiunge il valore minimo di energia potenziale a cui corrisponde la costituzione del legame tra i due atomi.
Una volta costituito il legame, le distribuzioni elettroniche si mescolano a formare una nuvola elettronica comune che circonda entrambi i nuclei dei due atomi. Il guadagno di stabilità che si osserva dalla situazione iniziale dei singoli atomi e quella corrispondente alla formazione della molecola, si traduce nella liberazione di energia, che prende il nome di energia di legame. A questo punto, per poter dividere i due atomi bisognerebbe fornire una egual quantità di energia, che in questo caso prende il nome di energia di dissociazione. Quest’ultima è uguale in valore assoluto all’energia di legame ma di segno opposto.
Ipoteticamente, se la distanza interatomica diminuisse ulteriormente, l’energia di repulsione aumenterebbe al punto da rendere il sistema instabile.
Classificazione dei legami chimici
Gli atomi possono interagire tra di loro in modo molto diverso tra loro e ciò comporta la formazione di altrettanti diversi legami chimici. Generalmente vengono identificate due macro-categorie:
- legami chimici primari (o interatomici) sono interazioni forti che si instaurano tra gli atomi che compongono la stessa molecola;
- legami chimici secondari (o interatomici) sono legami più deboli che si realizzano tra atomi di molecole diverse.
All’interno di queste due macro-categorie possono essere individuate poi una serie di legami chimici differenti.
Legami chimici primari
Un legame primario presuppone che vi sia la condivisione o il trasferimento di uno (o più) elettroni tra atomi. Pertanto si distinguono due tipologie di legami chimici primari:
- legame covalente, a sua volta suddiviso in polare e omopolare (o puro)
- legame ionico
Questa classificazione è stabilita sulla base dell’elettronegatività che contraddistingue ciascun atomo. In altre parole, descrive la capacità di un atomo ad attrarre a sé elettroni allo scopo di formare un legame chimico. Un atomo contraddistinto da un elevato grado di elettronegatività tende ad attrarre maggiormente un elettrone, al contrario di atomi contraddistinte da una bassa elettronegatività.
La differenza di elettronegatività tra due atomi, calcolata in funzione dell’energia di dissociazione, determina la tipologia di legame chimico: covalente tra 0 e 1.7, ionico per valori superiori a 1.7 (Figura 2).
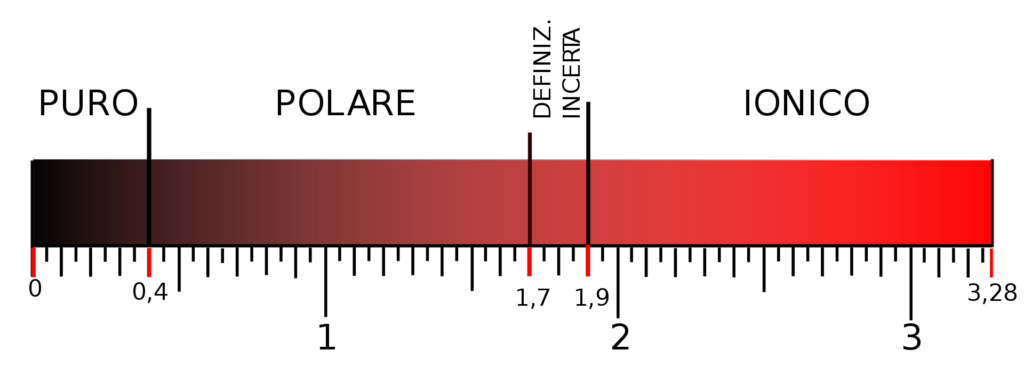
L’elettronegatività è un parametro relativo, ovvero viene stabilito in relazione ad un altro atomo in quella che è definita scala di Pauling. Il chimico statunitense prendendo come elemento di riferimento l’idrogeno (con valore di elettronegatività pari a 2.1) ha stabilito i valori degli altri elementi compresi tra 0.7 (del Francio, Fr) e 4.0 (del Fluoro, F). Dando uno sguardo alla tavola periodica si può apprezzare l’andamento dell’elettronegatività e la relazione fra i valori di elettronegatività e i diversi elementi (Figura 3).
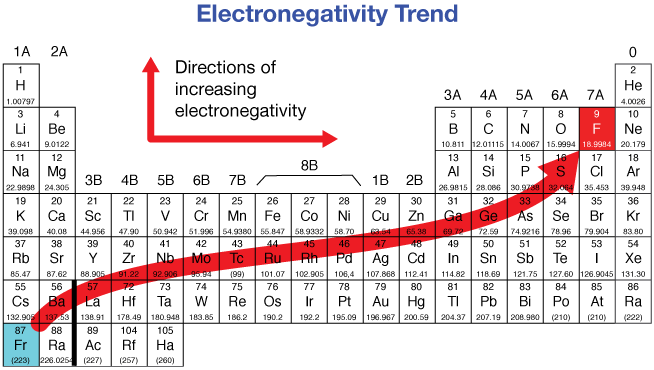
In generale, l’elettronegatività tende ad aumentare lungo il periodo (da sinistra a destra) della tavola periodica e a diminuire lungo il gruppo (dall’alto verso il basso). Gli elementi più elettronegativi, dunque, sono il gruppo degli alogeni, l’ossigeno, l’azoto e lo zolfo. Al contrario i metalli alcalino e alcalino terrosi sono quelli che presentano una bassa elettronegatività. I metalli di transizione, invece, fanno eccezione e non seguono tale andamento.
Inoltre, il concetto di elettronegatività è strettamente correlato all’affinità elettronica e all’energia di ionizzazione. La prima esprime il carattere di un atomo ad attrarre un elettrone, mentre la seconda descrive la tendenza di un atomo a non perdere un elettrone. Per cui, l’elettronegatività è direttamente proporzionale sia all’affinità elettronica che all’energia di ionizzazione.
Legami chimici secondari
I legami secondari sono una classe di legami chimici che si instaurano tra le molecole e sono molto più deboli dei precedenti. Come accennato in precedenza, una molecola è formata da atomi che esprimono una elettronegatività molto diversa. Questa caratteristica fa sì che la distribuzione elettronica non sia equa e ciò comporta uno spostamento di densità elettronica che rende la molecola parzialmente carica. Pertanto, le molecole possono instaurare tra di loro dei legami elettrostatici, noti come forze di Van der Waals di cui un esempio è il legame idrogeno (Figura 4).

Legami metallici
Il legame metallico è un particolare tipo di legame che si instaura principalmente nei metalli. Gli atomi di metallo, generalmente possiedono pochi elettroni nel guscio di valenza più esterno e quindi sono persi con estrema facilità, comportando la formazione di una carica positiva. In altre parole il legame metallico altro non è che un legame delocalizzato di tipo elettrostatico secondo cui si forma un reticolo di ioni positivi tenuti assieme da questa nube di elettroni liberi di muoversi.
Fonti
- Brain B. Laird, Chimica Generale, 2010, pp. 161-205, ISBN: 978-88-386-6560-8
- ch301.cm.utexas.edu/section2.php?target=atomic/bonding/bonding-all.php
- Potenziale di Morse – Wikipedia
- Legame metallico – Wikipedia
Ti consigliamo: I modelli atomici