Introduzione alle proteine
Le proteine, dette anche protidi, costituiscono la classe di molecole organiche più abbondanti in tutti gli organismi viventi e anche nella cellula ne rappresentano la maggior parte del peso secco. Sono macromolecole costituite da una o più lunghe catene polipeptidiche sintetizzate nei ribosomi unendo più amminoacidi. A loro volta le lunghe catene sono costituite da atomi di carbonio, idrogeno, ossigeno e azoto, ma talvolta sono presenti anche atomi di ferro, zolfo e fosforo.
A guidare e a determinare la sequenza con cui devono unirsi gli amminoacidi è l’m-RNA o RNA messaggero, copia a filamento unico di un gene che nella fase di traduzione proteica funge da filamento stampo per la proteina; perciò l’RNA messaggero viene utilizzato per stabilire la sequenza e unire gli amminoacidi attraverso legami peptidici per condensazione di un gruppo amminico di un amminoacido con il gruppo carbossilico del successivo.
Se le subunità delle proteine complesse sono uguali, basta un singolo gene a codificare per quella proteina; se le subunità sono invece diverse, ciascun tipo di subunità viene prodotta a partire da un gene.
Da queste molecole viene considerato spesso, ai fini scientifici di ricerca e analisi, il loro peso molecolare e il punto isoelettrico. A seconda della complessità della proteina, il peso molecolare può variare dai 5000 ai 10.000 Dalton (Da). Il punto isoelettrico è il valore di pH al quale una molecola presenta carica elettrica netta nulla.
Le proteine non sono strutture rigide, anzi, hanno parti mobili. Quasi tutte le proteine sintetizzate nei ribosomi, infatti, possono subire modificazioni post-traduzionali, di tipo covalente, in cui all’evento chimico è associato un’azione meccanica.
Le modificazioni covalenti possono essere irreversibili e reversibili. Nel primo caso si ottiene una proteina modificata irreversibilmente in uno o più punti della sua struttura primaria. Questa situazione si verifica quando si vuole promuovere l’interazione della proteina modificata con alcune specifiche strutture cellulari, a conferire alla proteina modificata una specifica attività enzimatica o a segregarla in determinati compartimenti cellulari dove deve svolgere la sua funzione biologica. Rientrano in queste reazioni le trasformazioni o scissioni proteolitiche specifiche.
Nel secondo caso le modificazioni possono essere rimosse da enzimi differenti, che ripristinano la molecola proteica originaria (sistema di attivazione e disattivazione della funzione biologica di una data proteina. Rientrano in questo gruppo le reazioni di fosforilazione-defosforilazione, di acetilazione-deacetilazione, di ADP-ribosilazione di molte proteine e di polimerizzazione-depolimerizzazione).
Classificazione delle proteine
Le proteine possono essere classificate in modo diverso a seconda dei parametri che si considerano:
| PARAMETRO DI CLASSIFICAZIONE | TIPOLOGIE | ESEMPI |
| composizione chimica | p. semplici e coniugate | istoni; glicoproteine |
| forma molecolare | p. globulari e fibrose | emoglobina; collagene |
| solubilità in acqua | criterio poco usato | |
| funzione biologica | regolatoriadi riservadi trasportostrutturaledi protezione | enzimi (amilasi), ormoni proteici, ferritina, emoglobina, collagene, fattori coagulazione, anticorpi |
| origine | p. animali e vegetali |
Struttura delle proteine
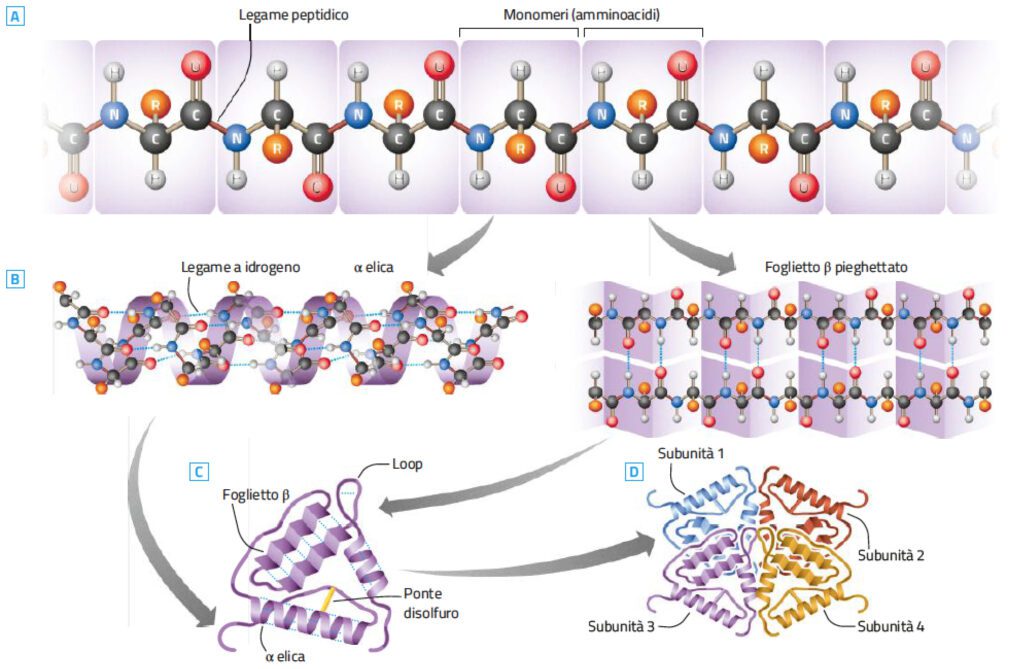
Si è detto, appunto, che le proteine sono costituite da numerose molecole di α-amminoacidi (detti anche residui amminoacidici), legate fra loro mediante legami peptidici tra il gruppo carbossilico di un amminoacido e il gruppo amminico di quello successivo, costituendo nel loro insieme una catena polipeptidica. Ma di tutti gli amminoacidi presenti in natura, solo 20 sono i costituenti fondamentali delle proteine.

La sequenza dei diversi amminoacidi costituenti la catena polipeptidica determina la struttura primaria di una proteina.
La disposizione strutturale, determina la struttura secondaria data dalle relazioni steriche, degli amminoacidi che si trovano vicini nella sequenza lineare e permettono alla proteina di ripiegarsi a formare una struttura ripetitiva regolare. Due sono le forme conformazionali più comuni: l’α-elica (elica destrogira che si forma quando una singola catena polipeptidica gira regolarmente attorno a se stessa) e la struttura foglietto β (che si ottiene quando una catena polipeptidica si ripiega avanti e indietro su se stessa).
A grandi linee, l’α-elica è una struttura che si riscontra più frequentemente nelle proteine globulari, in genere solubili in acqua, mentre la struttura β foglietto ripiegato è caratteristica delle proteine fibrose di solito insolubili in acqua.
Le strutture secondarie regolari, le α-eliche e i β-foglietti, rappresentano solo la metà della struttura di una proteina media. La rimanente parte dei segmenti della catena polipeptidica ha conformazioni a forma di «spirale» (coil) o di «ansa» (loop).
La struttura terziaria descrive la disposizione spaziale delle proteine ed è il prodotto dell’interazione tra le catene laterali degli amminoacidi costituenti la proteina che assume, così, una ben definita conformazione tridimensionale. La carica positiva o negativa posseduta dalle catene laterali permette l’attrazione o la repulsione fra loro. I legami tra le catene laterali possono essere sia legami idrogeno, sia i cosiddetti ponti salini.
Le proteine che sono costituite da più di una catena polipeptidica possiedono un ulteriore livello di organizzazione strutturale, la struttura quaternaria, che si riferisce al modo in cui le catene proteiche si associano tramite interazioni non covalenti o legami covalenti trasversali. Ogni catena polipeptidica di queste macromolecole, dette oligomeriche o polimeriche a seconda del numero complessivo di catene che le compongono, costituisce una subunità. La proteina oligomerica più conosciuta, e una tra le più semplici, è l’emoglobina.
Funzioni delle proteine
Queste molecole biologiche hanno diverse funzioni così riassumibili:
- regolatoria: gli enzimi regolano la velocità di reazioni chimiche o di un ciclo metabolico; le proteine ormonali regolano l’attività cellulare fisiologica
- di riserva: servono da sostanze nutritive e da materiale costruttivo per la crescita embrionale o adulta
- di trasporto: legano e trasportano nel sangue ioni o molecole più complesse, permettendone il trasferimento da un organo a un altro; vi sono proteine di trasporto nelle membrane cellulari, in grado di legare e trasportare, per es., glucosio, amminoacidi, ioni inorganici, con meccanismi diversi.
L’actina e la miosina, per es., sono i principali elementi proteici del sistema contrattile del muscolo scheletrico.
- strutturale: come filamenti di supporto, cavi o lamine per dare ai sistemi biologici robustezza e protezione.
- protettiva e di difesa: fanno parte di questo gruppo le proteine della coagulazione del sangue, la catalasi, la glutatione-perossidasi e la superossidodismutasi, che proteggono le cellule dalla tossicità delle specie radicaliche dell’ossigeno. Inoltre, le immunoglobuline, o anticorpi, prodotte dai linfociti. Anche le tossine batteriche, le proteine tossiche delle piante e i veleni dei serpenti possono essere considerati proteine di difesa di tali organismi.
Metabolismo proteico
Le proteine alimentari hanno sia funzione plastica sia energetica anche se in misura minore rispetto a carboidrati e grassi.
Le proteine del nostro organismo vengono continuamente rinnovate e, pertanto, dobbiamo assumerle con la dieta. In particolar modo, gli aminoacidi essenziali non possono essere prodotti dall’organismo e quindi devono provenire dalla nostra alimentazione. Gli aminoacidi non essenziali possono essere prodotti dall’organismo.
Fonte di proteine sono sia alimenti di origine vegetale che animale. Questi due tipi di proteine differiscono per: 1) la quantità di alcuni aminoacidi essenziali, noti come aminoacidi limitanti, 2) la biodisponibilità e 3) la digeribilità.
La digestione delle proteine inizia nello stomaco ad opera dell’enzima pepsina; si completa poi nell’intestino per azione degli enzimi tripsina e chimotripsina contenuti nel del succo pancreatico e delle peptidasi del succo enterico. Gli enzimi così riottenuti sono poi assorbiti dalla mucosa intestinale, entrano nel circolo sanguigno e vengono utilizzati dall’organismo.
I peptidi possono entrare nell’enterocita tramite il meccanismo della transcitosi e lì vengono scissi da amminopeptidasi citosoliche. Gli amminoacidi ottenuti vengono in parte utilizzati nel metabolismo dell’enterocita e in parte trasportati nel sangue tramite carrier (assorbimento). Diversi ormoni controllano il metabolismo proteico: l’ormone somatotropo, gli androgeni e la tiroxina che controlla sia il metabolismo che il catabolismo delle proteine.
Leggi anche
- Sintetizzare proteine con un codice ridotto – link
- Cosa succede nel tuo intestino alle proteine che mangi? – link
- Il microbiota influenza l’appetito per le proteine? – link
Fonti
- Bruce Alberts, Dennis Bray, Julian Lewis et al. “Biologia molecolare della cellula” terza edizione
- https://www.dbcf.unisi.it/sites/st13/files/allegati/28-03-2014/2-struttura_delle_proteine.pdf
- https://www.eufic.org/it/cosa-ce-nel-cibo/articolo/cosa-sono-le-proteine-e-qual-e-la-loro-funzione-nel-corpo
- https://www.docenti.unina.it/webdocenti-be/allegati/materiale-didattico/366765
- https://www.dbcf.unisi.it/sites/st13/files/allegati/28-03-2014/2-struttura_delle_proteine.pdf