Quorum sensing come sistema di controllo globale
Alcuni batteri possiedono sistemi di regolazione dipendenti dalla percezione della densità di cellule della stessa specie presenti nella popolazione; questo tipo di controllo è stato definito quorum sensing (QS). Il QS fa parte dei sistemi di controllo globale: complessi sistemi di regolazione coinvolti nei meccanismi di patogenicità e virulenza che permettono a un organismo di rispondere efficientemente ai segnali dell’ambiente, come quello rappresentato, nel caso specifico, dalla presenza di altri microrganismi della stessa specie. I batteri rilevano la presenza di altri batteri nel loro intorno producendo e rispondendo con molecole segnale conosciute come autoinduttori.
Autoinduttori
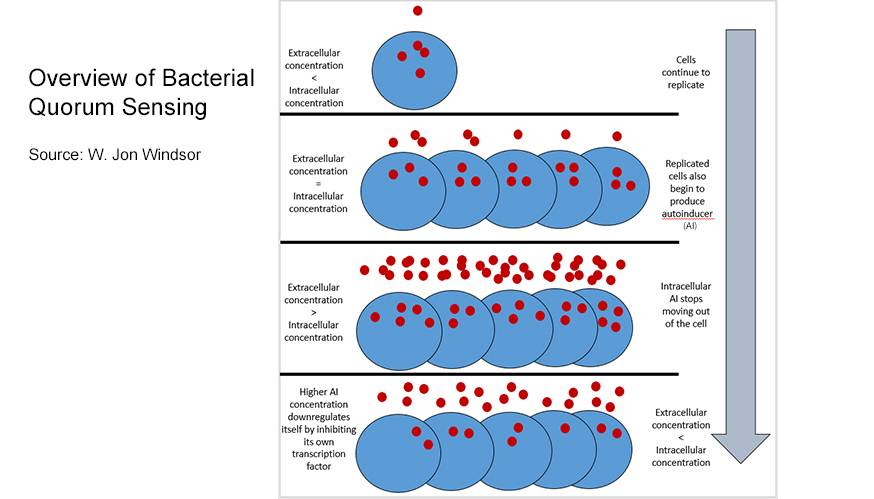
Queste molecole si accumulano al di fuori delle cellule microbiche e, superata una certa soglia (detta quorum), possono innescare una serie di eventi che si succedono con effetto “a cascata”. I meccanismi chimici sui quali si fonda il QS dei batteri gram-negativi sono differenti da quelli dei batteri gram-positivi. I batteri gram-negativi utilizzano come autoinduttori le molecole di acil-omoserina-lattone (AHL), derivati degli acidi grassi. Queste molecole sono rilasciate dalle cellule e si accumulano nelle colture, in funzione della densità cellulare.
Raggiunto il quorum, le molecole di AHL accumulate penetrano all’interno della cellula batterica dove possono interagire con proteine citoplasmatiche capaci di legare il DNA, inducendo una variazione dell’espressione genica. Nel tipico circuito LuxIR (sistemi autoinduttori di tipo 1) dei batteri gram-negativi, le proteine tipo LuxI catalizzano la sintesi degli autoinduttori, mentre le proteine tipo LuxR sono fattori trascrizionali che, complessati alle molecole di AHL, regolano l’espressione di geni target.
I batteri gram-positivi utilizzano come molecole di trasmissione del segnale piccoli peptidi ciclici con un anello tiolattone chiamati autoinduttori peptidici (AIP). Si tratta di oligopeptidi di circa 8-9 aminoacidi, prodotti nel citoplasma come precursori peptidici, dove subiscono delle modificazioni post-traduzionali prima di essere secreti.
Sistema regolatore a 3 componenti (3CRS)
Il circuito canonico di Quorum sensing identificato sia in batteri gram-positivi che gram-negativi è costituito dal sistema regolatore a 3 componenti (3CRS) e vede il coinvolgimento di molecole autoinduttrici (1° componente), che interagiscono con uno specifico recettore di membrana, una proteina chinasi sensore (che rappresenta il 2° componente), e di una proteina citoplasmatica che funge da regolatore della risposta (3° componente), che una volta fosforilata è capace di legare il DNA e regolare la trascrizione di geni target.
Alcuni batteri gram-negativi presentano un sistema Quorum sensing differente (sistema autoinduttore di tipo 3), l’ultimo tra quelli scoperti e probabilmente il più complicato. Tale sistema presenta molte caratteristiche comuni con i sistemi 3CRS, ma può utilizzare gli ormoni dello stress umano come adrenalina o noradrenalina come molecole segnale. La molecola ligando microbica che attiva il recettore del sistema non è stata chiaramente definita, ma è probabilmente simile alle catecolamine. Questi sistemi QS svolgono un ruolo cruciale nella patogenesi delle infezioni da Sighella ed E. coli enteroemorragici (EHEC) e in altri microrganismi enterici gram-negativi.
Sfruttando il QS, i batteri sono capaci di mettere in atto attività coordinate. Questa caratteristica fornisce parecchi vantaggi alla popolazione microbica quali la capacità di migrare verso un altro ambiente dove si trovino migliori condizioni di habitat e di nutrienti, l’adozione di nuovi modelli di sviluppo che potrebbero costituire una difesa contro le aggressioni esterne. Grazie al QS i batteri possono regolare diversi fenomeni:
- la formazione di biofilm
- l’emissione di bioluminescenza
- l’induzione di fattori di virulenza
- la crescita competitiva tra differenti popolazioni
- la sporulazione
- la coniugazione
- i processi di infezione degli organismi superiori
- la sintesi di molecole antimicrobiche
- la differenziazione di linee cellulari.
Inoltre, sempre grazie al QS all’interno della popolazione, i batteri possono modulare la manifestazione di determinate caratteristiche fenotipiche rispetto ad altre, secondo le necessità. Il QS è stato identificato, per la prima volta, nel 1970 come una forma di regolazione della bioluminescenza in alcuni batteri, ed è stato particolarmente studiato in Vibrio fischeri. L’operone lux, che codifica le proteine coinvolte nella bioluminescenza, è sotto il controllo della proteina attivatrice LuxR ed è indotto quando la concentrazione di AHL diventa sufficientemente elevata.
La proteina AHL in questo caso è sintetizzata dal gene luxI. In Pseudomonas aeruginosa è ormai chiaro che il QS è una risposta globale che porta all’espressione di un ampio numero di geni quando la densità della popolazione diventa sufficientemente elevata. Questo fenomeno contribuisce alla formazione da parte di P. aeruginosa di biofilm che costituiscono un aspetto molto importante nel processo di patogenicità.
La patogenicità di S. aureus comporta la produzione e la secrezione di numerose proteine della superficie cellulare ed extracellulare in grado di danneggiare le cellule o i tessuti dell’ospite o che interferiscono con il sistema immunitario. I geni che codificano questi fattori di virulenza sono sotto il controllo di un sistema di QS che risponde a un peptide prodotto dall’organismo. La regolazione di questi geni è alquanto complessa e coinvolge in parte una molecola di RNA regolatore. Il QS in S. aureus coinvolge anche proteine regolatrici che fanno parte di sistemi a due componenti di trasduzione del segnale e costituiti da due diverse proteine: una specifica proteina chinasi sensore, localizzata nella membrana cellulare, e una proteina regolatrice della risposta, generalmente una proteina di legame al DNA che regola la trascrizione di geni di virulenza molti dei quali deputati alla sintesi di tossine (tossina della sindrome da shock TSST1, δ-tossina, tossine esfolianti e alcune enterotossine).
Fonti
- Didelot, X. et al. (2016), «Within-host evolution of bacterial pathogens», Nat Rev Microbiol, 14(3), pp. 150-62.
- Fleischmann, R.D. et al. (1995), «Whole-genome random sequencing and assembly of Haemophilus influenzae Rd», Science, 269(5223), pp. 496-512.
- Goodwin, S. et al. (2016), «Coming of age: ten years of next-generation sequencing technologies», Nat Rev Genet, 17(6), pp. 333-351.
- Johnson, C.M. et al. (2015), «Integrative and Conjugative Elements (ICEs): what they do and how they work», Annu Rev Genet, 49, pp. 577-601.
- Margulies, M. et al. (2005), «Genome sequencing in microfabricated high-density picolitre reactors», Nature, 437(7057), pp. 376-380.
- Ronaghi, M. et al. (1996), «Real-time DNA sequencing using detection of pyrophosphate release», Anal. Biochem., 242(1), pp. 84-89.
- Sanger, F. et al. (1977), «DNA sequencing with chain-terminating inhibitors», Proc Natl Acad Sci USA, 74(12), pp. 5463-5467.
- Sboner, A. et al. (2011), «The real cost of sequencing: higher than you think!» Genome Biology, 12:125.
- Service, R.F. (2006), «Gene sequencing. The race for the $1000 genome», Science, 311(5767),pp. 1544-1546.
1 commento su “Quorum sensing”